
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)
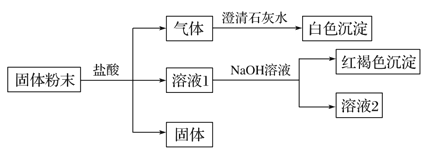
已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)白色沉淀是__________________(填化学式)。
(2)生成红褐色沉淀的离子方程式为______________________。
(3)根据实验现象, 固体粉末中一定存在的组分是___________________________ (填化学式)。
【答案】CaCO3 Fe3++3OH—= Fe(OH)3↓ SiO2、Fe2O3、K2CO3
【解析】
固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,由实验流程可知,加盐酸生成的气体能使石灰水变浑浊,则气体为CO2,溶液1与NaOH反应生成红褐色沉淀,沉淀为氢氧化铁,则原固体一定含Fe2O3,可知没有CuO,与盐酸反应后得到的固体为SiO2,又蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色,为K的焰色反应,则原固体中含K2CO3。
(1)白色沉淀为二氧化碳与氢氧化钙反应生成的CaCO3,故答案为CaCO3;
(2)生成红褐色沉淀的离子方程式为Fe3++3OH-=Fe(OH)3↓,故答案为Fe3++3OH-=Fe(OH)3↓;
(3)由上述分析可知,一定含SiO2、Fe2O3、K2CO3,可能含NaHCO3,一定不含CuO,故答案为SiO2、Fe2O3、K2CO3


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
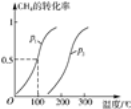
①已知100 ℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____。
②图中的P1___P2(填“<”、“>”或“=”),100 ℃时平衡常数为____。
③在其他条件不变的情况下降低温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) Ⅱ
CH3OH(g) Ⅱ
①该反应的ΔH______0,ΔS_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是(____)
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
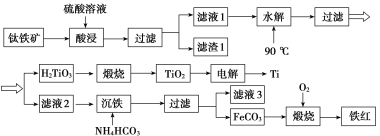
已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-等六种微粒,其中N2的物质的量随时变化曲线如图所示,下列判断正确的是( )
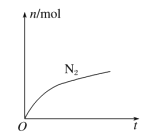
A.该反应的氯元素被氧化
B.反应后溶液的酸性明显减弱
C.消耗1 mol还原剂,转移3 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是
A.由C(s,石墨)=C(s,金刚石) H=+1.9 kJ/mol,可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq) =H2O(l) H=-57.3 kJ/mol,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g) =2H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
![]()
A.若X单质即可与强酸,也可与强碱溶液反应,则M单质可做半导体
B.若M、Z、Y皆存在简单阴离子,则离子半径:M>Z>Y
C.若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
D.若四种元素的原子序数之和为56,则Z的单质可以用作自来水的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
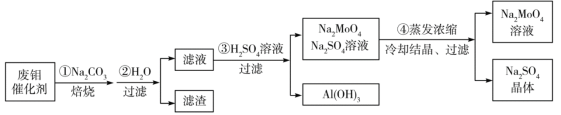
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
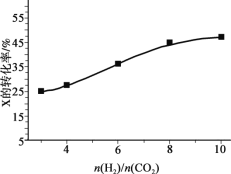
反应物X是_______(填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
(5)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)CH3CH2OH(g)。当n(H2O):n(C2H4)=1
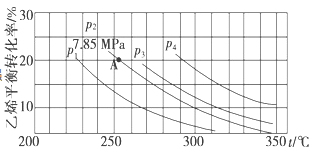
①图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
②气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com