
����Ŀ���±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ���Ӧԭ�Ӱ뾶�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||||
A | B | C | D | E | F | G | H | |
ԭ�Ӱ뾶(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
����ϼ� | +6 | +5 | +4 | +5 | +7 | +1 | ||
��ͻ��ϼ� | ��2 | ��3 | ��4 | ��2 | ��3 | ��1 | ��1 | 0 |
��֪����A��D���γɻ�����AD2��AD3����E��D���γɶ��ֻ��������ED��ED2�dz����Ļ����C�������ƹ��ء�
(1)�õ���ʽ��ʾA���⻯��������H ������������Ӧˮ���ﷴӦ���ɵ��ε��γɹ��̣�____________________________________________________________��
(2)E�ļ���̬�⻯�K������ˮ��ԭ���У���_____________________________��
��____________________________________________��
(3)�������ΪADG2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᡣ�÷�Ӧ�Ļ�ѧ����ʽ��_______________��
(4)����״����40L��ɫ����ED��15L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Ρ���д���÷�Ӧ�����ӷ���ʽ_______________________��
���𰸡�![]() �������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ NH3��H2O���Ӽ��γ�����������˰������ܽ�� SOCl2��H2O��2HCl��SO2�� 8NO + 3O2 + 8OH- = 2NO3-+6NO2- + 4H2O��
�������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ NH3��H2O���Ӽ��γ�����������˰������ܽ�� SOCl2��H2O��2HCl��SO2�� 8NO + 3O2 + 8OH- = 2NO3-+6NO2- + 4H2O��
��������
������Ԫ�أ�A��D����ͻ��ϼ�-2�����ڵڢ�A�壬A����ϼ�+6����Aԭ�Ӱ뾶�ϴ�AΪSԪ�أ�DΪOԪ�أ�B��E�����������+5�������-3�����ڢ�A�壬B��ԭ�Ӱ뾶�ϴ���BΪPԪ�ء�EΪNԪ�أ�C�������+4�������-4�����ڢ�A�壬ԭ�Ӱ뾶�ϴ���CΪSiԪ�أ�F��G������ͻ��ϼ�-1�����ڢ�A�壬G����������ϼ�+7����ԭ�Ӱ뾶�ϴ���FΪFԪ�ء�GΪClԪ�أ�H��������ϼ�Ϊ+1��ԭ�Ӱ뾶����Si�����HΪNaԪ�أ��Դ������
(1) AΪSԪ�أ����⻯��ΪH2S��HΪNaԪ�أ�������������Ӧˮ����ΪNaOH�� H2S������NaOH��Ӧ���ɵ���ΪNa2S���õ���ʽ��ʾNa2S���γɹ���Ϊ��![]() ��
��
��2��E�ļ���̬�⻯��NH3��������ˮ��ԭ���Ǣٰ������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ����NH3��H2O���Ӽ��γ�����������˰������ܽ�ȣ�
��3���������ΪACH2��������SOCl2����ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣬ���Ը�������SO2������ԭ���غ��֪��ǿ��Ӧ�������ᣬ���Ը÷�Ӧ�Ļ�ѧ����ʽ��SOCl2��H2O��2HCl��SO2����
��4��EDΪNO������������40L:15L=8:3�ı�����Ӧ����Ӧ�����ӷ���ʽΪ��8NO + 3O2 + 8OH-��2NO3-+6NO2- + 4H2O��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������һ�����Ϳɳ���أ�����ͨ�����ȣ��õ���ܽϳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn��2K2FeO4��8H2O![]() 3Zn(OH)2��2Fe(OH)3��4KOH����ش��������⣺
3Zn(OH)2��2Fe(OH)3��4KOH����ش��������⣺
����֪���ŵ�ʱ�������ĵ缫��ӦʽΪZn-2e-��2OH-=Zn(OH)2����������ӦʽΪ__��
�ڷŵ�ʱ��_____(����������������)��������Һ�ļ�����ǿ��
��2��ij��ȼ�ϵ�صĹ���ԭ��ʾ����ͼ��ʾ��a��b��Ϊ���Ե缫��
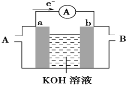
��ʹ��ʱ��������_____��ͨ��(����A������B��)��
�ڼ���ʹ�õ���ȼ�����Ǽ״�(CH3OH)��a���ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Һ����ȷ���Ƿ����������ӣ�K����Mg2����Fe3����Ba2����SO42-��Cl����I����HCO3-��ʵ�����£�
ʵ�鲽�� | ʵ������ |
���ò�����պȡ��������Һ������pH��ֽ�в� | ��ֽ��Ϊ��ɫ |
��ȡ��������Һ������BaCl2��Һ | �а�ɫ�������� |
��ȡ���з�Ӧ����ϲ���Һ������AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
��ȡ��������Һ������NaOH��Һ | ֻ�к��ɫ�������� |
�����ж���ȷ���ǣ�������
A.��Һ��������ֻ��Fe3��
B.����û��Na������ɫ��Ӧ�۲�K��ʱ��������ɫ���ܲ���
C.����û�в���٣�Ҳ��Ӱ����Һ�����ӵ��ж�
D.����ܷ�����Ӧ�����ӷ���ʽֻ�У�Fe3����3OH��=Fe��OH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽�����ʽṹ������֮��Ĺ�ϵ��Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�顣�ش��������⣺
I��NaNH2�۵�(210��)��NaOH �۵�(318.4��)�ͣ� ����ԭ����ȷ���� ��__________��
A������ΪNaNH2��NaOH ����Է�������С��ǰ�߷��Ӽ�������С��
B��NaOH���ڷ��Ӽ����
C��NaNH2��NaOH�������ӻ�������۷е�ߵ������Ӽ���ǿ���йأ����������ӵ����Խ�ߣ����Ӱ뾶ԽС�����Ӽ�ǿ��Խ��(�����Ӿ���ľ�����Խ��)�����۵�Խ�ߡ�����ԭ�Ӱ뾶N��O����NH2- ��OH- ԭ�Ӹ����࣬��NH2- ��OH- ���Ӱ뾶������NaNH2��NaOH���Ӿ���ľ�����С�����۵�͡�
D��N��O�����ڵڶ����ڣ�N����ͬ����Ԫ�ش����ң�Ԫ�صķǽ�������ǿ�����⻯��ˮ��Һ������H2O��NH3�������NaNH2��NaOH
II��������ͼ��ʾװ�ûش��������⡣

(1)ʵ����������ҩƷNa2S��KMnO4��Ũ���ᡢMnO2����ѡ�����ҩƷ���ʵ����֤Cl�ķǽ����Դ���S����ƿ�з�����Ӧ�����ӷ���ʽΪ_________________________���Թ��е�ʵ������Ϊ___________________________��
(2)��Ҫ�ô�װ��֤���ǽ����ԣ� N��C��Si������������������ѡ��ʵ����Ҫ�õ����ʣ�
��ϡHNO3��Һ ��ϡ������Һ ��̼��� ��Na2SiO3��Һ ��SiO2
�Լ�A��C�ֱ��ӦΪ_________________(���������)��
��ͬѧ��Ϊ��ʵ�鲻��˵��N��C��Si�ķǽ�����ǿ��������Ϊ�������ŵĻ�ѧ����ʽΪ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ŷŵ���Ⱦ����Ҫ��̼�⻯���һ����̼�͵�������ȡ�
I������ȼ�ͳ��ϰ�װ��Ԫ��ת����������Ч��������β����Ⱦ��
��1����֪�� C��s��+O2��g�� = CO2��g�� ��H1 �� 393.5kJ��mol1
2C��s��+O2��g�� = 2CO��g�� ��H2 �� 221.0 kJ��mol1
N2��g��+O2��g�� = 2NO��g�� ��H 3 ��+180.5 kJ��mol1
CO��NO����β���ڴ�������������N2���Ȼ�ѧ����ʽ��_______��
��2���о�CO��NO�Ĵ���Ӧ�������崫���������ij�¶��¡�һ��������ܱ������У���ͬʱ��NO��COŨ�����±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO��/��104mol��L1�� | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c��CO��/��103mol��L1�� | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�� ǰ4 s�ڵ�ƽ����Ӧ��������CO�� ��______mol��L1��s1��
�� L��X�ɷֱ����ѹǿ���¶ȡ���ͼA��ʾLһ��ʱ��NO��g����ƽ��ת������X�ı仯��ϵ��X��������������___________���ж�L1��L2�Ĵ�С��ϵ�����������ɣ�_________��

��3��ʵ���ã�v��=k����c2��NO����c2��CO����v��=k����c��N2�� ��c2��CO2����k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���_________������>������<���� ��=����k������ı�����
������2 L���ܱ������г���1 mol CO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk�� =_____________��������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeOCr2O3�������ж������衢�����������ʡ��Ʊ�������ͼ��ʾ��
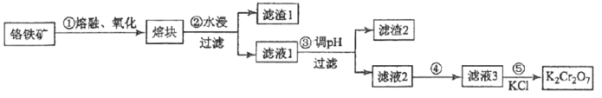
(1)����ٵ���Ҫ��ӦΪ��FeOCr2O3+NaOH+O2![]() Na2CrO4+Fe2O3+H2O ��
Na2CrO4+Fe2O3+H2O ��
������Ӧ��ƽ���������뻹ԭ����ϵ����Ϊ__________��
����ʵ�����н��в�������Ӧ����_______�н���(�����)
A.ʯӢ���� B.�������� C.���������� D.�մ�����
(2)����1�к������Ľ���Ԫ����__________(��Ԫ�ط���)������2����Ҫ�ɷ���_________���������ʣ�����������Һ1��pHʹ֮��_________(������������С��)
(3)������Һ3���м�������KCl�����ᾧ���˵õ�K2Cr2O7���塣�������ķ�Ӧ������___________��Ӧ��
(4)ij������380 kg �������(��Cr2O3 40%)�Ʊ�K2Cr2O7�����յõ���Ʒ250 kg������Ϊ________��100%(����2λ��Ч���֣�M(Cr2O3)=152g/mol��M(K2Cr2O7)=294g/mol)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĩ�п��ܺ���SiO2��Fe2O3��CuO��NaHCO3��K2CO3��ijͬѧ��Ʋ��������ʵ�飺(�����Լ�������)
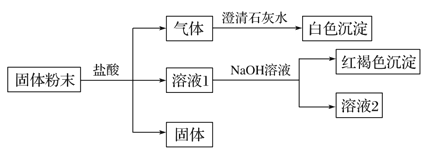
��֪��պȡ������Һ2�ھƾ��������գ�����ɫ�ܲ����۲�������ɫ��
��ش�
��1����ɫ������__________________(�ѧʽ)��
��2�����ɺ��ɫ���������ӷ���ʽΪ______________________��
��3������ʵ������ �����ĩ��һ�����ڵ������___________________________ (�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
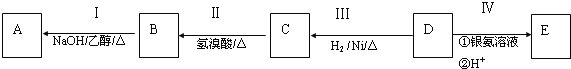
����Ŀ���л���AΪ����������ͼ��������Է�������Ϊ70������ط�Ӧ��ͼ��ʾ������B��D��E�Ľṹ�о�����2��![]() �����ǵĺ˴Ź��������о�����4���壮
�����ǵĺ˴Ź��������о�����4���壮
��ش�
![]() �����������ŵ�����Ϊ______��D�ķ���ʽΪ______��
�����������ŵ�����Ϊ______��D�ķ���ʽΪ______��
![]() ��ķ�Ӧ����Ϊ______
��ķ�Ӧ����Ϊ______![]() ����ĸ���
����ĸ���![]() ��
��
![]() ��ԭ��Ӧ
��ԭ��Ӧ![]() �ӳɷ�Ӧ
�ӳɷ�Ӧ![]() ������Ӧ
������Ӧ![]() ��ȥ��Ӧ
��ȥ��Ӧ
![]() д�����з�Ӧ�Ļ�ѧ����ʽ��
д�����з�Ӧ�Ļ�ѧ����ʽ��
��______��
��______��
![]() ��E����һ�������·�Ӧ����F��FΪ����ζ���л�������÷�Ӧ�Ļ�ѧ����ʽΪ______��
��E����һ�������·�Ӧ����F��FΪ����ζ���л�������÷�Ӧ�Ļ�ѧ����ʽΪ______��
![]() ��ͬ���칹������һ�Ի�Ϊ˳���칹���ҽṹ����2��
��ͬ���칹������һ�Ի�Ϊ˳���칹���ҽṹ����2��![]() �����ǵĽṹ��ʽΪ______��______��
�����ǵĽṹ��ʽΪ______��______��
![]() ����һ��ͬ���칹���ܷ���������Ӧ�����������������������������ܷ�����ȥ��Ӧ����ṹ��ʽΪ______��
����һ��ͬ���칹���ܷ���������Ӧ�����������������������������ܷ�����ȥ��Ӧ����ṹ��ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������pHΪ2�����ᣬ����������ȷ���ǣ� ��
A.��10mL����Һϡ����100mL��pH=4
B.�����Һ�м�������pHΪ12�İ�ˮǡ����ȫ�к�
C.����Һ������������c(H+)��ˮ�������c(H+)֮��Ϊ1010��1
D.����Һ����ˮ�������c(H+)ˮ��c(OH-)ˮ=1��10-14
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com