
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)
【答案】2NO(g)+2CO(g) =N2(g)+2CO2(g) △H =746.5 kJ·mol1 2.25 ×104 温度 L2>L1;该反应为气体体积减小的反应,相同温度下压强增大,NO转化率增大 < 0.5
【解析】
(1)根据盖斯定律进行计算;
(2)平均反应速率为![]() ,反应为放热反应,正反应气体体积减小,根据勒夏特列原理进行分析;
,反应为放热反应,正反应气体体积减小,根据勒夏特列原理进行分析;
(3)反应平衡时,正反应速率等于逆反应速率,物质浓度为反应平衡时的物质的量,不是反应变化量,据此进行计算。
(1)根据盖斯定律,CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是2NO(g)+2CO(g) =N2(g)+2CO2(g) △H =2△H1 -△H2 -△H3 =746.5 kJ·mol1。
(2)① 根据图表可知,前4 s内一氧化碳的浓度变化为0.9×103mol·L1,平均反应速率υ(CO) =![]() mol·L1·s1。
mol·L1·s1。
② L、X可分别代表压强或温度。根据上述热反应方程式可知,反应为放热反应,正反向的气体体积减小。若在同样L条件下,X增大,一氧化氮的转化率下降,说明X为温度,即L为压强。在同温条件下,L2的转化率高于L1,该反应为气体体积减小的反应,相同温度下压强增大,NO转化率增大,L2>L1。
(3)①达到平衡后,仅升高温度,正反应为放热反应,反应逆向移动,k正增大的倍数<k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,即反应消耗了0.4mol一氧化碳,0.4mol一氧化氮,生成了0.4mol二氧化碳和0.2mol氮气,到达平衡时v正v逆,即k正·c2(NO)·c2(CO)=k逆·c(N2) ·c2(CO2),则k正︰k逆=![]() 。
。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】现有①BaCl2固体 ②金刚石 ③NaOH固体 ④固体甲烷四种物质,按下列要求填空:
(1)熔化时不需要破坏化学键的是____(用序号填空,下同),只含离子键的是____,属于共价化合物的是____,熔点最高的是____。
(2)写出NaOH的电子式____,甲烷的空间构型____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的化学品。
(1)画出采用氨催化氧化法合成硝酸的反应原理流程图:(要求注明试剂、反应条件)
(示例:![]() )
)
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,是侯氏制碱法的关键步骤,用一个化学方程式表示该反应原理 。在0.1 mol/L的稀氨水中,下列式子成立的是 。
A.c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B.c(NH3·H2O) > c(NH3) + c(NH4+)
C.c(H+) > c(OH-)
D.c(NH4+) + c(H+) = c(OH-)
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为 ,物质B中所含的化学键类型有 。
(4)将6.4 g铜粉投入一定量的浓硝酸中,铜完全溶解,产生标准状况下的混合气体3.36 L,其中两种成分气体的体积比为 ,反应中总共消耗的硝酸 mol。
(5)向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设生成的气体只有一种,请在坐标系中画出n(气体)随n(Fe)变化的示意图,并标出n(气体)的最大值。
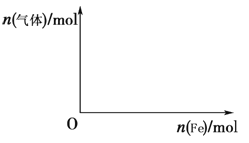
(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
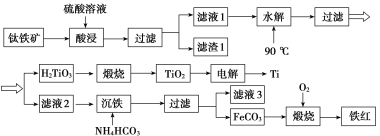
已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是一种常用香料的主要成分之一,其合成路线如下。
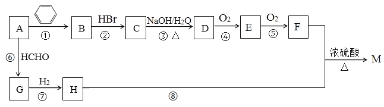
已知:
①相同条件下1体积烃A完全燃烧消耗4体积氧气;
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
③反应①的原子利用率为100%,反应类型属于加成反应;
④M的分子式为C13H18O2。
回答下列问题:
(1)A的名称为___________;G分子中有___ _个碳原子在同一条直线上。
(2)反应②~⑧中属于加成反应的是______;H中官能团的名称为___________。
(3)物质M的结构简式为____________。B的一种同类别异构体存在顺反异构,该物质发生加聚反应生成的高分子化合物的结构简式为_____________。
(4)反应③的化学反应方程式为_______________。
(5)符合下列条件的F的同分异构体共有_____种。
①能发生银镜反应;②能发生水解反应;③属于芳香族化合物。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (任写一种物质的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-等六种微粒,其中N2的物质的量随时变化曲线如图所示,下列判断正确的是( )
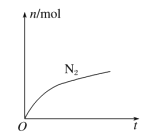
A.该反应的氯元素被氧化
B.反应后溶液的酸性明显减弱
C.消耗1 mol还原剂,转移3 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
![]()
A.若X单质即可与强酸,也可与强碱溶液反应,则M单质可做半导体
B.若M、Z、Y皆存在简单阴离子,则离子半径:M>Z>Y
C.若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
D.若四种元素的原子序数之和为56,则Z的单质可以用作自来水的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL。在相同温度、压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )
2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )
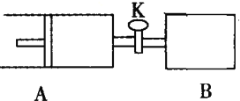
A.反应速率:v(B)>v(A)
B.A容器中X的转化率为80%
C.平衡时的压强:PB=PA
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com