
【题目】现有①BaCl2固体 ②金刚石 ③NaOH固体 ④固体甲烷四种物质,按下列要求填空:
(1)熔化时不需要破坏化学键的是____(用序号填空,下同),只含离子键的是____,属于共价化合物的是____,熔点最高的是____。
(2)写出NaOH的电子式____,甲烷的空间构型____。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】某学生探究小组将一批废弃的电子线路板简单处理后,得到含71%Cu、20%Al、5%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

已知:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
回答下列问题:
(1)滤渣1的主要成分为___。
(2)第②步加入H2O2目的是将Fe2+氧化成Fe3+,其离子方程式为___;使用H2O2作为氧化剂的优点是___。
(3)用第③步所得CuSO4·5H2O晶体加热制备无水CuSO4的瓷质主要仪器___。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中,可行方案是___,其中不可行方案的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有100mLHNO3溶液的烧杯中加入一定量的Cu、Al合金(还原产物为NO ),充分反应后向溶液中加入lmol/L的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如下图所示。则原HNO3溶液的物质的最浓度是

A. 0.4mol/L B. 0.45mol/L C. 0.525mol/L D. 0.625mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )
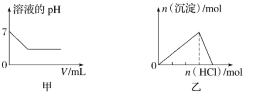
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
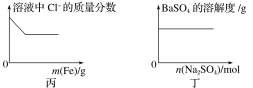
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
A. 在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①已知:放电时,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应式为__。
②放电时,_____(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
①使用时,空气从_____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟探究CuCl2·2H2O的热稳定性,进行如下操作:
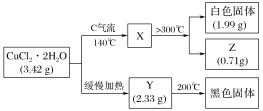
上述所列物质都是纯净物,请回答:
(1)气流C的结构式________,白色固体的化学式________。
(2)已知Y的摩尔质量为233 g·mol-1,完成CuCl2·2H2O缓慢加热分解的化学方程式_______。
(3)最简单制取白色固体的化合反应方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
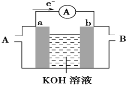
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )
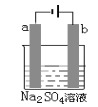
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com