
【题目】如下图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL。在相同温度、压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )
2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )
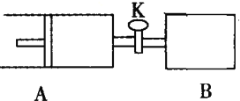
A.反应速率:v(B)>v(A)
B.A容器中X的转化率为80%
C.平衡时的压强:PB=PA
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
【答案】C
【解析】
对X(g)+Y(g)![]() 2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减小,其反应速率也要减小。对于B容器来说,体积不变,反应混合物的总物质的量会增大,所以反应体系的压强逐渐增大。
2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减小,其反应速率也要减小。对于B容器来说,体积不变,反应混合物的总物质的量会增大,所以反应体系的压强逐渐增大。
A.在建立平衡前,由于B的气体压强增大,根据压强对化学反应速率的影响可知,每个时刻的反应速率B都将大于A容器,即反应速率:v(B)>v(A),正确;
B.根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2mol=2.8mol,即增加了0.8mol,根据化学方程式的计算可知,
X(g)+Y(g)![]() 2Z(g)+W(g) △n
2Z(g)+W(g) △n
1 1
0.8mol 0.8mol
即达平衡后,反应掉0.8mol,A容器中X的转化率为80%,正确;
C.由于A是在恒压条件下进行的反应,B在恒容条件下进行的该反应。该反应的正反应是气体体积扩大的反应,所以从反应开始至达到平衡,反应体系的压强B>A,错误;
D.由于A是恒压条件下进行反应,平衡时向A容器中充入与反应无关的气体M,使容器的容积扩大,使反应混合物中各组成成分的物质的量浓度减小,所以化学反应速率减慢,正确。
故选C。


科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
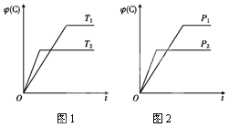
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是
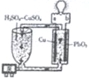
A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号 | H2C2O4溶液 | 酸性KMnO4 | 温度 | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥__。
(2)试验编号②和③探究的内容是____。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=___mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。

(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
![]() 浓硫酸与木炭在加热条件下反应的化学方程式是 ______ 。
浓硫酸与木炭在加热条件下反应的化学方程式是 ______ 。
![]() 试用图所列各种装置设计一个实验来验证上述反应所产生的各种产物。
试用图所列各种装置设计一个实验来验证上述反应所产生的各种产物。
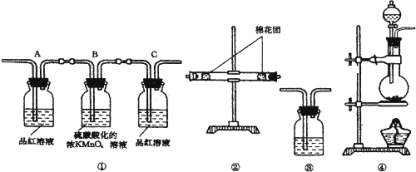
这些装置的连接顺序,按产物气流从左到右的方向是![]() 填装置的编号
填装置的编号![]() : ______
: ______ ![]() ______
______ ![]() ______
______ ![]() ______ 。
______ 。
![]() 装置
装置![]() 中所装的固体药品是 ______ ,可验证的产物是 ______ 。
中所装的固体药品是 ______ ,可验证的产物是 ______ 。
![]() 装置
装置![]() 中所盛溶液是 ______ ,可以验证的产物是 ______ 。
中所盛溶液是 ______ ,可以验证的产物是 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com