
����Ŀ����һ��Һ����ȷ���Ƿ����������ӣ�K����Mg2����Fe3����Ba2����SO42-��Cl����I����HCO3-��ʵ�����£�
ʵ�鲽�� | ʵ������ |
���ò�����պȡ��������Һ������pH��ֽ�в� | ��ֽ��Ϊ��ɫ |
��ȡ��������Һ������BaCl2��Һ | �а�ɫ�������� |
��ȡ���з�Ӧ����ϲ���Һ������AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
��ȡ��������Һ������NaOH��Һ | ֻ�к��ɫ�������� |
�����ж���ȷ���ǣ�������
A.��Һ��������ֻ��Fe3��
B.����û��Na������ɫ��Ӧ�۲�K��ʱ��������ɫ���ܲ���
C.����û�в���٣�Ҳ��Ӱ����Һ�����ӵ��ж�
D.����ܷ�����Ӧ�����ӷ���ʽֻ�У�Fe3����3OH��=Fe��OH��3��
���𰸡�C
��������
�ٲ�pH��ֽ��죬˵����Һ�����ԣ�HCO![]() ���ܴ������ڣ��ڲ�˵����SO
���ܴ������ڣ��ڲ�˵����SO![]() ��Ba2���Ͳ��ܴ������ڣ��۲�����˵����Cl������Ϊ����������Cl�����ܲ�˵����Fe3����
��Ba2���Ͳ��ܴ������ڣ��۲�����˵����Cl������Ϊ����������Cl�����ܲ�˵����Fe3����
A.��Һ��һ������Fe3����H�������ܺ���K+��A����
B.�����Ƿ���Na����ֻҪ�ǹ۲�ص���ɫ������������ɫ�ܲ�����B����
C.û�в���٣��ܲ�˵����Fe3����Ҳ��������Һ�����ԣ���Ӱ����Һ�����ӵ��жϣ�C��ȷ��
D.����ܷ����ķ�Ӧһ���У�Fe3����3OH��=Fe(OH)3����H����OH��=H2O��D����
��ѡC��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����ֱ����Ũ�ȡ�������Ĺ���ϡ���ᷴӦ��������������(v)��ʱ��(t)��ϵ����ͼ����Ӧ��þ������
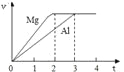
A. ���ʵ���֮��Ϊ3:2 B. ����֮��Ϊ3:2
C. Ħ������֮��Ϊ2:3 D. ��Ӧ����֮��Ϊ2:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ����������CH4��H2OΪԭ�����Ʊ��״���
(1)��1.0mol CH4��2.0mol H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ100L)����һ�������·�����Ӧ��CH4(g)��H2O(g) ![]() CO(g)��3H2(g)��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)��3H2(g)��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
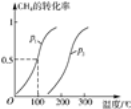
����֪100 ��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ____��
��ͼ�е�P1___P2(����<������>����������)��100 ��ʱƽ�ⳣ��Ϊ____��
���������������������½����¶ȣ��淴Ӧ���ʽ�____(����������������С������������)��
(2)��ѹǿΪ0.1MPa�����£���a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO(g)+2H2(g) ![]() CH3OH(g) ��
CH3OH(g) ��
���÷�Ӧ����H______0����S_____0(����<������>����������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ�����____��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1mol CO��3mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ��������������Ķ���������Ԫ�ء�X�ֱ���Y��Z��W����γ���������ͬ�ļס��ҡ������ַ��ӡ���Ϊ��ɫ���壬�����������ɫ������ˮ��Һ�ɿ�ʴ������
������������ͼת����ϵ��

����˵���������
A. ����Ԫ���γɵĵ�����W����������ǿ
B. �ס��ҡ����зе���ߵ��DZ�
C. �׳����������
D. �ס��ҷ��Ӿ�ֻ�����Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ļ�ѧƷ��
��1���������������������ϳ��������Ӧԭ������ͼ����Ҫ��ע���Լ�����Ӧ������
��ʾ����![]() ��
��
��2�����Ȼ��ƺ�Ũ��ˮ�Ļ����Һ��ͨ�����CO2�Ӷ�����NaHCO3���壬�Ǻ����Ƽ�Ĺؼ����裬��һ����ѧ����ʽ��ʾ�÷�Ӧԭ�� ����0.1 mol/L��ϡ��ˮ�У�����ʽ�ӳ������� ��
A��c(NH3��H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B��c(NH3��H2O) > c(NH3) + c(NH4+)
C��c(H+) > c(OH-)
D��c(NH4+) + c(H+) = c(OH-)
��3��A����ѧ��ѧ�������壬��װ��A�ļ���ƿ��ƿ�ڳ��ְ�������A�백����ϣ��������ִ������̣���������B����A�ķ���ʽΪ ������B�������Ļ�ѧ�������� ��
��4����6.4 gͭ��Ͷ��һ������Ũ�����У�ͭ��ȫ�ܽ⣬������״���µĻ������3.36 L���������ֳɷ�����������Ϊ ����Ӧ���ܹ����ĵ����� mol��
��5����4 mol HNO3��ϡ��Һ�У������������������������ɵ�����ֻ��һ�֣���������ϵ�л���n(����)��n(Fe)�仯��ʾ��ͼ�������n(����)�����ֵ��
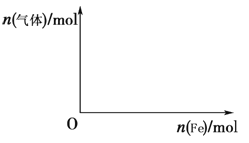
��6�����������������ĵ�����������Ȼ���ײ�����ֽ⣬���ֽ�ʱֻ�������������д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�ǻ�ѧʵ����������л����������ˮ����������ζ���й����ʵ�ת����ϵ��ͼ��
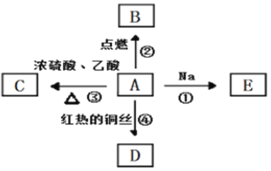
��ش�
��1��A�����й����ŵ�������________________��
��2����װ��������Һ���Թ��м���3��D��Һ����ˮԡ���ȡ�д�����Ⱥ�۲쵽������________________��
��3����Ӧ�۵Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������[��Ҫ�ɷ�Ϊ��������( FeTiO3)������MgO��SiO2������]Ϊԭ�ϣ��Ʊ������Ѻ�����Ĺ����������£�
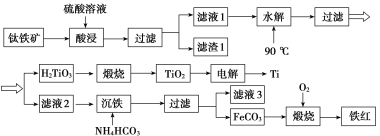
��֪�������ʱ�� FeTiO3ת��ΪFe2����TiO2�����ڱ�ʵ���¶��£�Ksp[Mg(OH)2]��1.0��10��11����ش��������⣺
(1)���ʱ�����߽�ȡ�ٶȺͽ�ȡ��_____________________________(���ٴ����ַ���)��
(2)��ˮ��������H2TiO3�����ӷ���ʽΪ_________________________��
(3)�������������У���̬����ĵ���ʽΪ__________________���ù�������Ʒ�Ӧ�¶ȵ���35 �棬ԭ��Ϊ___________________________________________________��
(4)��Һ3�������Ʊ�Mg(OH)2������Һ3��c(Mg2��)��1.0��10��3 mo/L�������м���NaOH���壬������ҺpHֵ����________ʱ����ʹMg2��������ȫ��
(5)�������ʱ�������Ϊ���ڵ�CaO�����缫����Ϊʯī������_______��ʯī����Ҫ���ڸ�����ԭ����__________________________________________________________��
(6)�ⶨ�����Ʒ���ȣ���ȡm g���죬����һ����������֮�У����500.00 mL��Һ����������ȡ20.00 mL��Һ�����������KI����ַ�Ӧ���� c mol/L���������(Na2S2O3)��Һ�ζ����յ㣬������Ӧ��I2��2S2O![]() ===S4O
===S4O![]() ��2I����ƽ�еζ����Σ����������ƽ���������ΪV mL���������Ʒ�Ĵ���Ϊ________(��c��V��m��ʾ)��
��2I����ƽ�еζ����Σ����������ƽ���������ΪV mL���������Ʒ�Ĵ���Ϊ________(��c��V��m��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ���Ӧԭ�Ӱ뾶�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||||
A | B | C | D | E | F | G | H | |
ԭ�Ӱ뾶(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
����ϼ� | +6 | +5 | +4 | +5 | +7 | +1 | ||
��ͻ��ϼ� | ��2 | ��3 | ��4 | ��2 | ��3 | ��1 | ��1 | 0 |
��֪����A��D���γɻ�����AD2��AD3����E��D���γɶ��ֻ��������ED��ED2�dz����Ļ����C�������ƹ��ء�
(1)�õ���ʽ��ʾA���⻯��������H ������������Ӧˮ���ﷴӦ���ɵ��ε��γɹ��̣�____________________________________________________________��
(2)E�ļ���̬�⻯�K������ˮ��ԭ���У���_____________________________��
��____________________________________________��
(3)�������ΪADG2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᡣ�÷�Ӧ�Ļ�ѧ����ʽ��_______________��
(4)����״����40L��ɫ����ED��15L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Ρ���д���÷�Ӧ�����ӷ���ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƣ�Na2MoO4����һ��������ȼ����ˮ����������һ�ֺ���ķ�����������Ҫ�ɷ�ΪMoO3��Al2O3��Fe2O3�ȣ��пɻ���Na2MoO4���乤���������£�
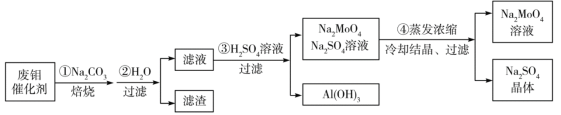
��֪��MoO3��Al2O3��SiO2���ƣ������ڸ�������Na2CO3�������Ʒ�Ӧ��
����������������
A.����ʱ������Ӧ֮һ��Al2O3+Na2CO3=2NaAlO2+CO2��
B.�������ȡ�ڲ�������������������KSCN����Һ��ΪѪ��ɫ
C.����������CO2��������
D.������п�֪Na2MoO4�ܽ�����¶ȱ仯��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com