
【题目】A是化学实验中最常见的有机物,它易溶于水并有特殊香味。有关物质的转化关系如图:
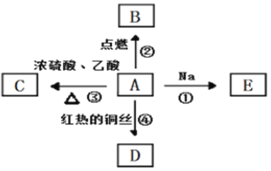
请回答:
(1)A分子中官能团的名称是________________。
(2)向装有银氨溶液的试管中加入3滴D溶液,振荡后水浴加热。写出加热后观察到的现象________________。
(3)反应③的化学方程式是________________。
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,![]() 与
与![]() 在多孔碳材料电极处生成
在多孔碳材料电极处生成![]() (
(![]() 或1)。下列说法正确的是
或1)。下列说法正确的是
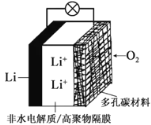
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断正确的是
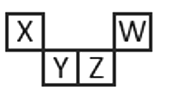
A.最高正化合价:X<Y<Z<W
B.原子半径:W<X<Y<Z
C.气态氢化物的热稳定性:Z<W
D.最高价氧化物对应水化物的酸性:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一溶液,欲确定是否含有下列离子:K+、Mg2+、Fe3+、Ba2+、SO42-、Cl-、I-、HCO3-,实验如下:
实验步骤 | 实验现象 |
①用玻璃棒蘸取少量该溶液,点在pH试纸中部 | 试纸变为红色 |
②取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
③取②中反应后的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
④取少量该溶液,加入NaOH溶液 | 只有红褐色沉淀生成 |
下列判断正确的是( )
A.溶液中阳离子只有Fe3+
B.由于没有Na+,焰色反应观察K+时不必用蓝色的钴玻璃
C.假如没有步骤①,也不影响溶液中离子的判断
D.步骤④发生反应的离子方程式只有:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是无色油状液体,具有苯的气味。化工上主要用于溶剂、分析试剂和有机合成等。某化学小组欲利用如图所示的装置通过实验探究:
Ⅰ.苯与液溴发生取代反应:已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O
Br2↑+MnSO4+Na2SO4+2H2O
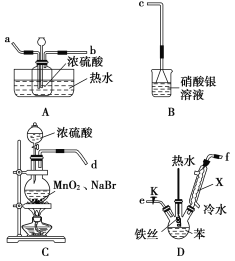
(1)仪器X的名称______________ ,实验室制备溴苯的化学方程式为____________________;
这样制取的溴苯中会溶解过量的Br2 ,可以用________洗涤除Br2。
A.Na2SO3溶液 B.H2O C.乙醇溶液 D.NaOH溶液
(2)制取溴苯的实验操作步骤如下:
①连接装置,其接口顺序为(填字母):d接________,________接________,________接c;
②检查装置的气密性;
③C中加入固体药品,滴加浓硫酸,再打开D处开关K,点燃C处酒精灯;将D装置中的铁丝插入混合液中,一段时间后,D中液体沸腾,原因是_____________________;
④关闭C中分液漏斗的旋塞。
(3)A中对广口瓶进行热水浴的目的_________________________________。
(4)若B中有淡黄色沉淀生成,能否确定苯与液溴发生了取代反应?________(答“能”或“否”)解释其中的原因_________________________________;
Ⅱ.探究苯与液溴在催化剂作用下的反应机理。
查阅文献:①Br+有强氧化性,可以和水分子发生氧化还原反应 ②苯与液溴在溴化铁催化下的反应机理共分三步:(填写下列空白)
第一步:Br2+FeBr3![]() Br++FeBr
Br++FeBr![]() 第二步:
第二步:![]()
请完成第三步反应:__________________________;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。

(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有二氧化硅、氧化铝等杂质。制备流程如图所示:
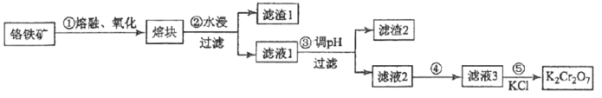
(1)步骤①的主要反应为:FeOCr2O3+NaOH+O2![]() Na2CrO4+Fe2O3+H2O 。
Na2CrO4+Fe2O3+H2O 。
上述反应配平后氧化剂与还原剂的系数比为__________。
若在实验室中进行步骤①,应该在_______中进行(填序号)
A.石英坩埚 B.铁制坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)滤渣1中含量最多的金属元素是__________(填元素符号);滤渣2的主要成分是_________及含硅杂质;步骤③调滤液1的pH使之变_________(填“大”或“小”)
(3)向“滤液3”中加入适量KCl,经结晶过滤得到K2Cr2O7固体。步骤⑤的反应类型是___________反应。
(4)某工厂用380 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品250 kg,产率为________×100%(保留2位有效数字,M(Cr2O3)=152g/mol;M(K2Cr2O7)=294g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种燃料电池:
下面是工作原理示意图,其中正极反应生成水的是

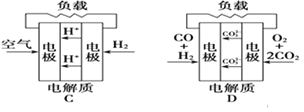
A.固体氧化物燃料电池
B.碱性氢氧化物燃料电池
C.质子交换膜燃料电池
D.熔融盐燃料电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com