
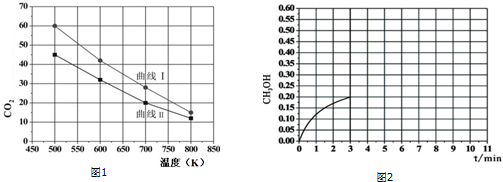
分析 (1)准确写出一氧化碳与氢气反应生成甲醇的方程式,将已知的两个热化学方程式进行运算得到目标方程式,依据盖斯定律计算反应热;
(2)依据△H-T△S<0反应能自发进行判断解答;
(3)化学平衡状态的特征:等,即V正=V逆,定,即达到平衡后反应物、生成物物质的量,质量,浓度,百分含量等保持不变据此判断解答;
(4)①根据速率v=$\frac{△C}{△t}$结合三行式进行计算;
②化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
③将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(5)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
解答 解:(1)把题中所给的两个热化学方程式分别记为①和②,
①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ/mol
②:CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
根据盖斯定律①-②得CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol;
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol;
(2)依据方程式:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ/mol该反应能自发进行则满足:△H-T△S<0,△H<0、△S<0,故应该在低温下能自发进行;
故答案为:低温;
(3)A.温度不变,平衡常数不变,故不能作为判断平衡的标志,故A错误;
B.所指的速率都是表示正反应速率,且比例不对,不能作为判断平衡标志,故B错误;
C.该反应前后气体体积不相等,则压强不变说明达到平衡,故C正确;
D.反应物和产物都是气体,则气体总质量不变、容器体积不变,则密度始终不变,故D错误;
E.混合气体的总质量不变,但反应前后气体的物质的量不等,则平均相对分子质量不变说明达到平衡,故E正确;
故选:CE;
(4)在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.75 1.5 0 0
变化浓度:0.45 1.35 0.45 0.45
平衡浓度:0.3 0.15 0.45 0.45
①.氢气表示的反应速率=$\frac{1.35mol/L}{10min}$=0.135 mol•L-1•min-1,故答案为:0.135 mol•L-1•min-1;
②.该温度下,反应I的平衡常数K=$\frac{0.45×0.45}{0.3×0.1{5}^{3}}$=200,
故答案为:200;
③.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为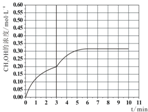 ,
,
故答案为: ;
;
(5)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.改用高效催化剂,能加快反应速率,但是不影响平衡的移动,故错误;
B.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
C.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
D.分离出甲醇,不能加快反应速率,故错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大;反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,综上所述,CO的浓度一定增大.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com