
【题目】氮的化合物既是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。
(Ⅰ)消除氮氧化物有多种方法。
(1)NH3 催化还原法:原理如图所示

①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为___________。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_________;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是__________。
(2)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右下图所示。阳极的电极反应式为__________。

(Ⅱ)氨是重要的化工原料,工业合成氨有重要现实意义。
(1)在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
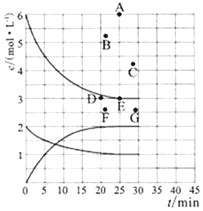
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00mol N2和12.00mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(2)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:2NO2(g)N2O4(g) H=-56.9kJmol-1,测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____________。
②已知该反应v正(NO2)=k1c2(NO2),v逆(N2O4)=k2c(N2O4),其中k1、k2为速率常数,则373K时,![]() =_________;改变温度至T1时,k1=k
=_________;改变温度至T1时,k1=k
【答案】2NH3(g)+NO(g)+NO2(g)= 2N2(g)+3H2O(g) ΔH=-455.2 kJ/mol Mn,200°C(附近也算对) b~a段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高; H2O+HNO2-2e-=NO3-+3H+ bc B 2×103mol/(L·min) 60 >
【解析】
(Ⅰ) (1)①若烟气中 c(NO2):c(NO)=1:1,发生如图甲所示的脱氮反应时,反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g),反应过程中转移 1.5mol 电子时放出的热量为 113.8kJ,电子转移6mol放热为455.2kJ,则标注物质聚集状态和对应反应的焓变得到热化学方程式;
②根据图乙分析,考虑适合的温度和高的脱氮率,据此选择合适的催化剂;
(2)用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,电解工作原理阳极失去电子,发生氧化反应,参与物质是硝酸来解答;
(Ⅱ) (1)①反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到不变时,说明可逆反应到达平衡状态;
②若起始充入4.00molN2和12.00molH2是充入2.00 molN2和6.00 molH2的2倍,相当加压、反应速率加快、达到平衡状态的时间缩短,但合成氨的正反应是气体体积减小的反应,增大压强、平衡正向移动,据此分析解答;
(2)①根据v=![]() 计算0~20min时的v(N2O4);
计算0~20min时的v(N2O4);
②反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以![]() =2×
=2×![]() =2K,根据反应三段式计算平衡时[φ(NO2)=0.4]各物质的平衡浓度,代入平衡常数K=
=2K,根据反应三段式计算平衡时[φ(NO2)=0.4]各物质的平衡浓度,代入平衡常数K=![]() 中计算K;该反应正向放热,升高温度,K减小,降低温度K增大。
中计算K;该反应正向放热,升高温度,K减小,降低温度K增大。
(Ⅰ) (1)①若烟气中 c(NO2):c(NO)=1:1,发生如图甲所示的脱氮反应时,反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g),反应过程中转移 1.5mol 电子时放出的热量为 113.8kJ,电子转移6mol放热为455.2kJ,则标注物质聚集状态和对应反应的焓变得到热化学方程式为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=455.2kJ/mol;
②根据图乙分析,200°C时Mn的催化效率更高,500°C时,Cr的催化效率更高,相比之下,200°C的耗能更少,则工业选取的最佳催化剂及相应的温度分别为:Mn、200°C;ba段,温度较低,催化剂活性较低,脱氮反应速率较慢,反应还没达到化学平衡(反应限度),随着温度升高反应速率变大,一定时间参与反应的氮氧化物变多,导致脱氮率逐渐升高;
(2)用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸,根据装置图,阳极发生氧化反应,亚硝酸被氧化为硝酸,电极反应式为H2O+HNO2-2e-=NO3-+3H+;
(Ⅱ) (1)①a.3v正(N2)=v逆(H2)的状态是平衡状态,所以v正(N2)=3v逆(H2)的状态不是平衡状态,故a错误;
b.该反应正向体积减小,恒温恒容条件下,反应正向进行、气体物质的量减小、压强降低,所以体系压强不变时达到平衡状态,故b正确;
c.体系中各物质均为气体,气体质量不变,该反应正向体积减小,恒温恒容条件下,反应正向进行、气体物质的量减小,气体平均相对分子质量增大,所以气体平均相对分子质量不变时达到平衡状态,故c正确;
d.体系中各物质均为气体,气体质量不变,恒温恒容条件下,气体密度始终不变,所以气体密度不变不能判定反应达到平衡状态,故d错误;
故答案为:bc;
②由图可知,将2.00molN2和6.00molH2充入1L密闭容器中,达到平衡时,c(H2)=3mol/L,即E点;若起始充入4.00molN2和12.00molH2,是恒容容器中充入的2.00 molN2和6.00 molH2的2倍,相当加压、反应速率加快、先达到平衡状态,但加压时平衡正向移动,使c(H2)小于6mol/L,故为B点;
(2)①设c(N2O4)=x,2NO2(g)N2O4(g),则c(NO2)=2x,起始时c(NO2)=0.2mol/L,20min时[φ(NO2)]=0.75,即![]() =0.75,x=0.04mol/L,020min时,v(N2O4)=
=0.75,x=0.04mol/L,020min时,v(N2O4)=![]() =2×103mol/(Lmin);
=2×103mol/(Lmin);
②反应三段式为:

平衡时φ(NO2)=0.4,![]() =0.4,y=0.075mol/L,平衡常数K=
=0.4,y=0.075mol/L,平衡常数K=![]() =
=![]() =30,反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以
=30,反应达到平衡时,v正(NO2)=2v逆(N2O4),即k1c2(NO2)=2k2c(N2O4),所以![]() =2×
=2×![]() =2K=60;2NO2(g)N2O4(g)△H=56.9kJmol1,升高温度平衡常数减小,T1时k1=k2,则
=2K=60;2NO2(g)N2O4(g)△H=56.9kJmol1,升高温度平衡常数减小,T1时k1=k2,则![]() =1=2K′,平衡常数K′=0.5<30,所以T1>373K。
=1=2K′,平衡常数K′=0.5<30,所以T1>373K。


科目:高中化学 来源: 题型:
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:

分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1L的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),下列示意图合理的是
2Z(g),下列示意图合理的是
A.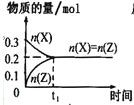 B.
B.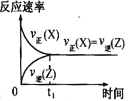
C.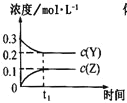 D.
D.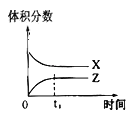
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用CO还原CuO的方法制备单质铜,某化学实验小组利用如图装置在实验室中模拟CO还原CuO的反应。
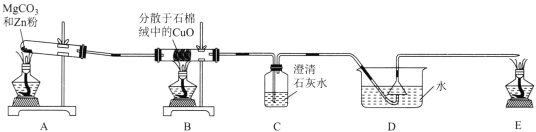
请回答下列问题:
(1)在装置A的试管中放入8.4gMgCO3和6.5gZn粉,点燃A处酒精灯,加热后即可得到纯净的CO,反应的化学方程式为__。
(2)装置B中盛放分散于石棉绒中的CuO的玻璃仪器的名称为__,将CuO附在石棉绒上的目的为__。
(3)首先点燃A处和E处的酒精灯,一段时间后发现装置D处倒置于水中的漏斗轻轻向上弹起又落下,同时伴有爆鸣声,产生该实验现象的原因为___。
(4)待D处倒置于水中的漏斗稳定后,点燃B处酒精灯,加热,当观察到装置C中__(填实验现象),可证明装置B中有CO2生成。
(5)实验时观察到从E处玻璃管尖嘴处点燃的CO的火焰颜色呈黄色,火焰呈黄色的原因是__。
(6)反应结束后,装置B中还原得到的Cu中含有少量的Cu2O,为测定反应生成的混合物中铜元素的质量分数,设计如下实验方案:取mg反应生成的混合物,加入稀硫酸和双氧水的混合液使固体全部溶解,微热,除去过量的过氧化氢,稀释成100mL溶液。取25mL该溶液,加入稍过量的KI溶液,再加入几滴淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。
已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O![]() =S4O
=S4O![]() +2I-。
+2I-。
①达到滴定终点的现象为__。
②反应生成的混合物中铜元素的质量分数为__(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中![]() 值增大,可以采取的措施是
值增大,可以采取的措施是
A.加少量烧碱B.降低温度C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素在生产生活中应用非常广泛,2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)是工业上合成氮肥尿素的主要方法,在生产条件下,单位时间内获得尿素的产量与压强及n(NH3):n(CO2)的关系如图甲所示。当氨碳比n(NH3):n(CO2)=4时,CO2的转化率随时间的变化关系如图乙所示。下列说法不正确的是
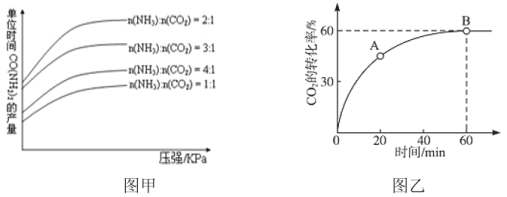
A.用NH3和CO2表示速率,v(NH3):v(CO2)=2:1
B.若开始投料按照n(NH3):n(CO2)为2∶1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)比压缩前小
C.A点的逆反应速率小于B点的正反应速率
D.由图乙可知NH3的平衡转化率为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,等体积、PH相同的盐酸和醋酸溶液分别加水稀释,溶液中的随溶液体积变化的曲线如图所示。据图判断下列说法正确的是

A.b点酸的总浓度大于a点酸的总浓度
B.b点溶液的导电性比c点溶液的导电性弱
C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同
D.曲线Ⅰ表示的是盐酸的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.该反应的ΔH>0、ΔS<0
B.体系的总压强p:p(Ⅰ)>p(Ⅲ)
C.平衡常数:K(Ⅰ)>K(Ⅱ)
D.T1K时,Ⅳ点所处的状态中v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com