
【题目】a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a︰b不可能为
A. 3︰4 B. 3︰2 C. 2︰3 D. 4︰5
【答案】B
【解析】
250℃时,NaHCO3固体可完全分解为Na2CO3、CO2、H2O(g),因CO2与NaOH能反应,故应依次考虑CO2、H2O(g)与Na2O2的反应,排出的两种气体为O2和H2O(g)。
加热时,2NaHCO3![]() Na2CO3+CO2↑+H2O(g),b mol NaHCO3生成b/2 mol CO2、b/2 mol H2O(g)。Na2O2先与CO2反应,2CO2+2Na2O2=2Na2CO3+O2①,Na2O2后与H2O(g)反应,2H2O+2Na2O2=4NaOH+O2②。要排出两种气体,必须①恰好反应或余Na2O2,且②余H2O(g),故b/2 ≤ a,a-b/2 < b/2,解得1︰2 ≤ a︰b < 1︰1。B项 3︰2不在此范围内。
Na2CO3+CO2↑+H2O(g),b mol NaHCO3生成b/2 mol CO2、b/2 mol H2O(g)。Na2O2先与CO2反应,2CO2+2Na2O2=2Na2CO3+O2①,Na2O2后与H2O(g)反应,2H2O+2Na2O2=4NaOH+O2②。要排出两种气体,必须①恰好反应或余Na2O2,且②余H2O(g),故b/2 ≤ a,a-b/2 < b/2,解得1︰2 ≤ a︰b < 1︰1。B项 3︰2不在此范围内。
本题选B。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中,甲烧杯中盛有100 mL 0.50 molL-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 molL-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则
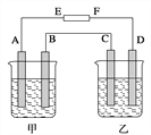
(1)电源E为________极。
(2)A极析出物质______ mol。
(3)B极的电极反应式为____________________。
(4)C极的电极反应式为_____________________。
(5)D极析出气体________ mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用4×10-3 mol的KZO4 恰好将60 mL 0.1 mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A. +6 B. +4 C. +3 D. +2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物B. 稀豆浆、盐酸、氯化铁溶液均为胶体
C. 烧碱、纯碱、金属铜均为电解质D. 盐酸、氯水、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
![]()
则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
① X元素的原子半径是所有原子中最小的
② Y元素的原子最外层电子数是最内层电子数的2倍
③ Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一
④ W与R能形成原子个数之比为2∶1和1∶1的离子化合物甲和乙。请回答问题:
(1)R在周期表中的位置是____________________
(2)Y、R、W三种元素的原子半径由大到小顺序为____________(用元素符号表示)。
(3)X2R与乙反应的化学方程式是_______________________________________
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)____________________________。0.1 mol·L-1的该溶液中,各种阴离子的浓度由大到小关系为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略): 
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全(Al3+的浓度为10-5mol/L),则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com