
【题目】X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
① X元素的原子半径是所有原子中最小的
② Y元素的原子最外层电子数是最内层电子数的2倍
③ Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一
④ W与R能形成原子个数之比为2∶1和1∶1的离子化合物甲和乙。请回答问题:
(1)R在周期表中的位置是____________________
(2)Y、R、W三种元素的原子半径由大到小顺序为____________(用元素符号表示)。
(3)X2R与乙反应的化学方程式是_______________________________________
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)____________________________。0.1 mol·L-1的该溶液中,各种阴离子的浓度由大到小关系为________________________
【答案】(10分)
(1)第二周期第ⅥA族(2分)
(2)Na>C>O(2分)
(3)2Na2O2+2H2O=4NaOH+O2↑(2分)
(4)CO32-+H2O![]() HCO3-+OH-(2分) c (CO32-)>c (OH-)>c (HCO3-) (2分)
HCO3-+OH-(2分) c (CO32-)>c (OH-)>c (HCO3-) (2分)
【解析】
试题 H元素的原子半径是所有原子中最小的,所以X是H元素;Y元素的原子最外层电子数是最内层电子数的2倍,则内层电子数不可能是10,也即Y元素不可能有3层电子,所以Y的内层电子数是2,最外层电子数是4,则Y是C元素;造成温室效应的气体是二氧化碳,所以R是O元素,与C形成CO和CO2两种化合物;W与R能形成原子个数之比为2:1和l:1的离子化合物甲和乙,则W是Na元素,与O元素形成的化合物Na2O、Na2O2都是离子化合物。
(1)R为O元素,位于元素周期表的第二周期第ⅥA族;
(2)C、O、Na三种元素中,Na的电子层数最多,所以Na的原子半径最大,C与O是同周期元素,原子半径随核电荷数的增加而减小,所以C的原子半径大于O,则三种元素的原子半径的关系是Na>C>O;
(3)乙为过氧化钠,与水反应生成氢氧化钠和氧气,化学方程式是2Na2O2+2H2O=4NaOH+O2↑;
(4)元素C、O、Na形成的化合物碳酸钠的水溶液常用作清洗厨房的油污,是因为碳酸根离子水解使溶液成碱性,可去油污,离子方程式是CO32-+H2O![]() HCO3-+OH-;碳酸钠溶液中的阴离子为氢氧根离子、碳酸根离子、碳酸氢根离子,因为溶液为碳酸钠溶液,水解反应毕竟是微弱的,所以碳酸根离子的浓度最大,因为水解生成碳酸氢根离子,水电离还产生氢氧根离子,所以氢氧根离子浓度大于碳酸氢根离子,则碳酸钠溶液中阴离子的浓度关系是c (CO32-)>c (OH-)>c (HCO3-)。
HCO3-+OH-;碳酸钠溶液中的阴离子为氢氧根离子、碳酸根离子、碳酸氢根离子,因为溶液为碳酸钠溶液,水解反应毕竟是微弱的,所以碳酸根离子的浓度最大,因为水解生成碳酸氢根离子,水电离还产生氢氧根离子,所以氢氧根离子浓度大于碳酸氢根离子,则碳酸钠溶液中阴离子的浓度关系是c (CO32-)>c (OH-)>c (HCO3-)。


科目:高中化学 来源: 题型:
【题目】卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。设R为烃基,已知:![]()
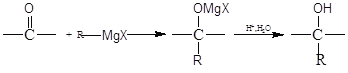
某有机物A有如下转化关系:
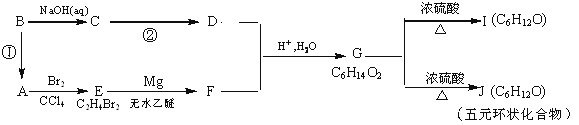
试回答下列问题:
(1) 反应①的反应试剂和实验条件是____________________
(2) C→D的化学反应方程式为___________________________;
(3) G的结构简式是______________________,G的最简单的同系物的名称是_______
(4)I中所含官能团的名称是_________________________
(5)能发生银镜反应的J的同分异构体有____种。写出其中含-CH3个数最多的异构体的结构简式__________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 molL-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 _________色变为______ 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 ______________________,由此造成的测定结果 _________________(偏高、偏低或无影响)
(4)步骤②缺少的操作是 ________________________________
(5)下图,是某次滴定时的滴定管中的液面,其读数为 _____________mL
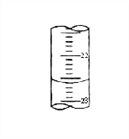
(6)V1 ______ V2 (填大于、小于、或等于)
(7)纠正错误以后实验测出下列数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.50 | 23.40 |
请计算待测烧碱溶液的浓度:____________________ molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a︰b不可能为
A. 3︰4 B. 3︰2 C. 2︰3 D. 4︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中对于相关物质的分类全部正确的是()
选项 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
A | 液氯 | 漂白粉 | Al2O3 | CO |
B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
C | 碱石灰 | 盐酸 | K2O | Cl2 |
D | 胆矾 | 水玻璃 | CaO | SO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
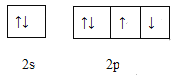
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
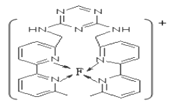
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出三个装置中所共同发生的两个反应的化学方程式: 、 ;
写出B盛AgNO3溶液的试管中所发生反应的化学方程式: 。
(2)装置A和C均采用了长玻璃导管,其作用是 。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是 ;
应对装置C进行的操作是 。
(4)B中采用了双球洗气管吸收装置,其作用是 ,反应后双球洗气管中可能出现的现象是 。
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com