
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
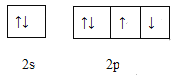
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
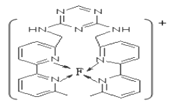
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
【答案】 Na 3d54s1 第三周期 ⅦA族 2Na2O2+2H2O=4Na++4OH-+O2↑ 洪特规则 平面三角形或正四面体 ![]() sp3和sp2
sp3和sp2
【解析】考查元素周期表和元素周期律的应用,W的最外层电子数是其内层电子数的3倍,即W为O,X是短周期中原子半径最大的元素,即X为Na,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,即Y为P,Z原子最外层有1个未成对电子,即Z为Cl,因为原子序数依次增大,又因为Q位于Y的不同周期,Q的核外成单电子是同周期中最多的,推出Q为Cr,F元素基态原子最外层有1个电子,推出F为Cu,(1)第一电离能越小,越容易失去电子,即四种元素中第一电离能最小的是Na;Cr为副族元素,价电子包括最外层电子数和次外层d能级上的电子,即Cr的价电子排布式为3d54s1;(2)Z为Cl,位于第三周期VIIA族;(3)O和Na形成具有非极性共价键的化合物是Na2O2,W的最简单氢化物是H2O,即离子反应方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;(4)洪特规则是同一能级中电子优先单独占据一个轨道,且自旋方向相同,此排布图违反了洪特规则;(5)M为PCl5,N为PCl3,P的价态与PCl5中P的价态相同,即显+5价,含氧酸根可以是PO3-或PO43-,前者空间构型为平面三角形,后者为正四面体;(6)PCl3中各原子达到8e-稳定结构,即PCl3的电子式为![]() ;(7)根据结构,有两种碳原子,一种含有碳碳双键,杂化类型为sp2,还有一种是-CH3,杂化类型sp3。
;(7)根据结构,有两种碳原子,一种含有碳碳双键,杂化类型为sp2,还有一种是-CH3,杂化类型sp3。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】0.1mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A. c(H+)>c(F-)B. c(HF) >c(H+)
C. c(OH-)>c(HF)D. c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物B. 稀豆浆、盐酸、氯化铁溶液均为胶体
C. 烧碱、纯碱、金属铜均为电解质D. 盐酸、氯水、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
① X元素的原子半径是所有原子中最小的
② Y元素的原子最外层电子数是最内层电子数的2倍
③ Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一
④ W与R能形成原子个数之比为2∶1和1∶1的离子化合物甲和乙。请回答问题:
(1)R在周期表中的位置是____________________
(2)Y、R、W三种元素的原子半径由大到小顺序为____________(用元素符号表示)。
(3)X2R与乙反应的化学方程式是_______________________________________
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)____________________________。0.1 mol·L-1的该溶液中,各种阴离子的浓度由大到小关系为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请利用下列装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后验证干燥的Cl2和潮湿的Cl2有无漂白性。按气体从左向右流向将各装置依次连接起来: a 接i,j接g,f接e,d接b,c接h,试回答:

(1)F装置中的试剂应为:_________,作用是_______________________。
(2)A装置中的主要玻璃仪器有:酒精灯、圆底烧瓶、________________。
(3)A装置中发生反应的化学方程式是_______________________________。
(4)E装置中发生反应的离子反应方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍,则该烃的分子式为_______。
(2)某烷烃B 含有16 个共价键,则该烃的同分异构体有______种。其一卤代物只有一种结构,此烃的结构简式为:____________。用系统法命名为:_______________。
(3)某烷烃 C 的结构简式为CH3CH2CH (CH3) 2,则该烃的一氯取代物有___种。
(4) 某烃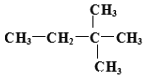 由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 g/cm3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 mol/L的硫酸。
(1)98 %的浓硫酸的物质的量浓度为_________。
(2)现有下列几种规格的量筒,应选用______(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
(3)实验需要以下步骤:
①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_______。
(4)下列操作使所配溶液的物质的量浓度偏高的是__________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com