
【题目】请利用下列装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后验证干燥的Cl2和潮湿的Cl2有无漂白性。按气体从左向右流向将各装置依次连接起来: a 接i,j接g,f接e,d接b,c接h,试回答:

(1)F装置中的试剂应为:_________,作用是_______________________。
(2)A装置中的主要玻璃仪器有:酒精灯、圆底烧瓶、________________。
(3)A装置中发生反应的化学方程式是_______________________________。
(4)E装置中发生反应的离子反应方程式是_______________________________。
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
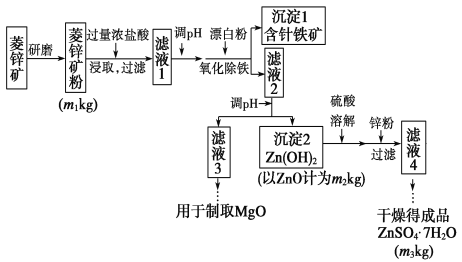
(1)完成“氧化除铁”步骤中反应的离子方程式:
(_________)Fe(OH)2+(________)________+(_________)______===(________)Fe(OH)3+(_________)Cl-
(2)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp mol3·L-3 | 5.6×10-12 | — | 6.8×10-10 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰粉 c.纯碱溶液 d.烧碱溶液
(5)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在周期表中的位置如图。下列说法正确的是
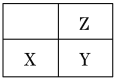
A. Z元素的最高化合价一定大于X元素
B. 三种元素原子半径由高到低的顺序一定是Y>X>Z
C. 若它们的原子最外层电子数之和为11,则X为金属元素
D. 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )
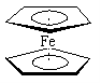
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.二茂铁分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
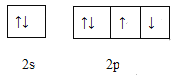
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
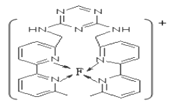
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如右图所示。下列表述不正确的是
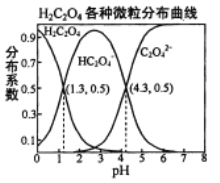
A. HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. 常温下HF的K=1×10-3.4,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/L NaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com