
【题目】0.1mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A. c(H+)>c(F-)B. c(HF) >c(H+)
C. c(OH-)>c(HF)D. c(HF)>c(F-)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。设R为烃基,已知:![]()
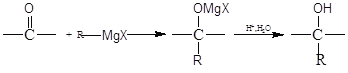
某有机物A有如下转化关系:
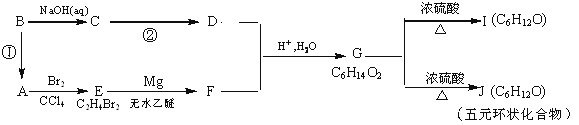
试回答下列问题:
(1) 反应①的反应试剂和实验条件是____________________
(2) C→D的化学反应方程式为___________________________;
(3) G的结构简式是______________________,G的最简单的同系物的名称是_______
(4)I中所含官能团的名称是_________________________
(5)能发生银镜反应的J的同分异构体有____种。写出其中含-CH3个数最多的异构体的结构简式__________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
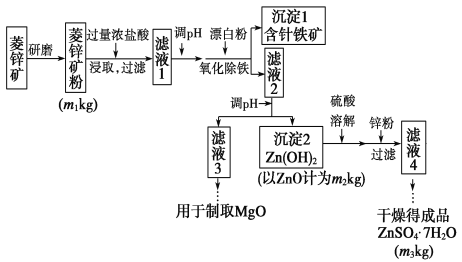
(1)完成“氧化除铁”步骤中反应的离子方程式:
(_________)Fe(OH)2+(________)________+(_________)______===(________)Fe(OH)3+(_________)Cl-
(2)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp mol3·L-3 | 5.6×10-12 | — | 6.8×10-10 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰粉 c.纯碱溶液 d.烧碱溶液
(5)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2 L恒容密团容器中充入2 mol X(g)和1mol Y(g)发生反应:2X(g)+ Y(g)![]() 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是

A. Q点时,Y的转化率最大
B. 升高温度,平衡常数增大
C. W点Y的正反应速率等于M点Y的正反应速率
D. 平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。生成的沉淀过滤除去后,则下列离子组在对应的溶液中一定能大量共存的是
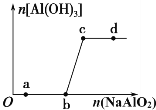
A. a点对应的溶液中:Na+、K+ HCO3- Cl-
B. b点对应的溶液中:Na+、OH-、SO42-、Cl-
C. c点对应的溶液中:Na+、K+、Ag+、NO3-
D. d点对应的溶液中:Na+、K+、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 molL-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 _________色变为______ 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 ______________________,由此造成的测定结果 _________________(偏高、偏低或无影响)
(4)步骤②缺少的操作是 ________________________________
(5)下图,是某次滴定时的滴定管中的液面,其读数为 _____________mL
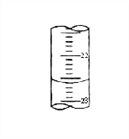
(6)V1 ______ V2 (填大于、小于、或等于)
(7)纠正错误以后实验测出下列数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.50 | 23.40 |
请计算待测烧碱溶液的浓度:____________________ molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
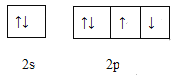
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
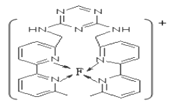
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com