
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍,则该烃的分子式为_______。
(2)某烷烃B 含有16 个共价键,则该烃的同分异构体有______种。其一卤代物只有一种结构,此烃的结构简式为:____________。用系统法命名为:_______________。
(3)某烷烃 C 的结构简式为CH3CH2CH (CH3) 2,则该烃的一氯取代物有___种。
(4) 某烃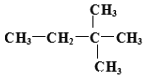 由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
【答案】 C6H14 3 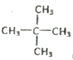 2,2-二甲基丙烷 4
2,2-二甲基丙烷 4 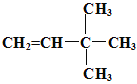 或
或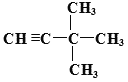
【解析】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍,则该烃的相对分子质量是43×2=86,根据烷烃的通式CnH2n+2可知14n+2=86,解得n=6,所以则该烃的分子式为C6H14;(2)根据烷烃的通式CnH2n+2可知烷烃分子中共价键个数是2n+2+n-1=3n+1。如果某烷烃B含有16个共价键,则3n+1=16,即n=5,因此该烃是戊烷,有正戊烷、异戊烷和新戊烷三种同分异构体;其一卤代物只有一种结构,则只有一种化学环境下的氢,此烃的结构简式为: 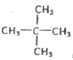 ;用系统法命名为: 2,2-二甲基丙烷;(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,分子中含有4类氢原子,则该烃的一氯取代物有4种;(4)烯烃或炔烃均可以与氢气加成得到烷烃,因此根据烷烃的结构简式可知烃D的可能的是
;用系统法命名为: 2,2-二甲基丙烷;(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,分子中含有4类氢原子,则该烃的一氯取代物有4种;(4)烯烃或炔烃均可以与氢气加成得到烷烃,因此根据烷烃的结构简式可知烃D的可能的是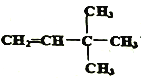 或
或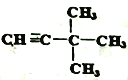 。
。
点晴:本题主要是考查有机物分子式确定。掌握烷烃的通式和结构特点是解答的关键,难点是(4)中有机物结构简式的判断。解答时注意根据烷烃分子中相邻的2个碳原子上各去掉一个氢原子即可形成形成碳碳双键,如果个去掉2个氢原子,则形成碳碳三键,解答时注意根据烷烃的结构简式灵活应用,但需要注意不要重复多写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 molL-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 _________色变为______ 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 ______________________,由此造成的测定结果 _________________(偏高、偏低或无影响)
(4)步骤②缺少的操作是 ________________________________
(5)下图,是某次滴定时的滴定管中的液面,其读数为 _____________mL
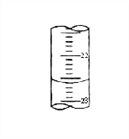
(6)V1 ______ V2 (填大于、小于、或等于)
(7)纠正错误以后实验测出下列数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.50 | 23.40 |
请计算待测烧碱溶液的浓度:____________________ molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q、F是六种原子序数依次增大的前四周期元素,其中W的最外层电子数是其内层电子数的3倍,X是短周期中原子半径最大的元素,X、Y、Z为同周期元素,Y原子的核外电子总数是其最外层电子数的3倍,Z原子最外层有1个未成对电子,Q位于Y的不同周期,且它核外成单电子是同周期中最多的,F元素基态原子最外层有1个电子。请回答下列问题:
(1)W、X、Y、Z四种元素中第一电离能最小的是__________(填元素符号);Q原子的价电子排布式为________;
(2)Z元素在周期表中的位置为___________________。
(3)W元素有两种同素异形体, W和X形成的化合物中含有非极性共价键的物质P,写出P与W的最简单氢化物反应的离子方程式__________________
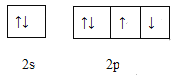
(4)下图是W元素的最外层电子排布图,它违背了电子排布的什么原则____________ 。
(5)Y单质和Z单质反应可生成原子个数比为1:5的化合物M和1:3的化合物N,与M中价态相同的Y的含氧酸根的立体构型为_____________。
(6)写出上问中N的电子式:__________________________
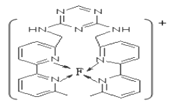
(7)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( )
A.0.1 mol/LB.0.15 mol/LC.0.2 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出三个装置中所共同发生的两个反应的化学方程式: 、 ;
写出B盛AgNO3溶液的试管中所发生反应的化学方程式: 。
(2)装置A和C均采用了长玻璃导管,其作用是 。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是 ;
应对装置C进行的操作是 。
(4)B中采用了双球洗气管吸收装置,其作用是 ,反应后双球洗气管中可能出现的现象是 。
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ/mol) | I1 | I2 | I3 | I4 |
X | 578 | 1817 | 2745 | 11578 |
Y | 738 | 1451 | 7733 | 10540 |
X通常显_____价,X的电负性____Y的电负性(填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________。
共价键 | C-C键 | C-N键 | C-S键 |
键能/(kJ/mol) | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ.mol-1) | 786 | 715 | 3401 |
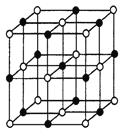
则这四种离子晶体的熔点从高到低的顺序是_______。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2中,适合作录音带磁粉原料的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com