
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物B. 稀豆浆、盐酸、氯化铁溶液均为胶体
C. 烧碱、纯碱、金属铜均为电解质D. 盐酸、氯水、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍,则该烃的分子式为_______。
(2)某烷烃B 含有16 个共价键,则该烃的同分异构体有______种。其一卤代物只有一种结构,此烃的结构简式为:____________。用系统法命名为:_______________。
(3)某烷烃 C 的结构简式为CH3CH2CH (CH3) 2,则该烃的一氯取代物有___种。
(4) 某烃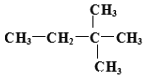 由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是______ (任写一种可能的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略): 
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全(Al3+的浓度为10-5mol/L),则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物中,都有多个官能团:
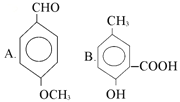
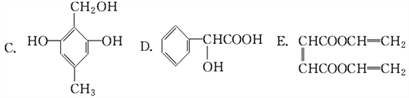
(1)可以看作醇类的是(填入编号,下同)________________。
(2)可以看作酚类的是_________________。
(3)可以看作羧酸类的是_________________。
(4)可以看作酯类的是_________________。
(5)可以看作醛类的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 g/cm3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 mol/L的硫酸。
(1)98 %的浓硫酸的物质的量浓度为_________。
(2)现有下列几种规格的量筒,应选用______(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
(3)实验需要以下步骤:
①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_______。
(4)下列操作使所配溶液的物质的量浓度偏高的是__________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是_______________,它的外围电子的电子排布图为 _______________________________,P元素属于_______区元素。
(2)XZ2分子的空间构型是________ ,YZ2分子中Y的杂化轨道类型为_________ ,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_____________________。
(3)含有元素N的盐的焰色反应为____色,许多金属盐都可以发生焰色反应,其原是________________________
(4)元素M与元素Q形成晶体结构如图1所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为_______________g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。 三聚氰胺分子中氮原子轨道杂化类型是______, 1 mol三聚氰胺分子中 σ键的数目为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com