
【题目】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是_______________,它的外围电子的电子排布图为 _______________________________,P元素属于_______区元素。
(2)XZ2分子的空间构型是________ ,YZ2分子中Y的杂化轨道类型为_________ ,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_____________________。
(3)含有元素N的盐的焰色反应为____色,许多金属盐都可以发生焰色反应,其原是________________________
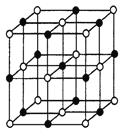
(4)元素M与元素Q形成晶体结构如图1所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为_______________g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。 三聚氰胺分子中氮原子轨道杂化类型是______, 1 mol三聚氰胺分子中 σ键的数目为______。

【答案】第三周期ⅥA族![]() dsV型spSO2SO2为极性分子, CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较紫电子由较高能级跃迁到较低能级时,以光的形式释放能量
dsV型spSO2SO2为极性分子, CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较紫电子由较高能级跃迁到较低能级时,以光的形式释放能量![]() sp2、sp315NA
sp2、sp315NA
【解析】
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数29,则P为Cu元素。
由分析可以知道:X为S元素;Y为O元素;Z为O元素;M为Ca元素;N为K元素;Q为F元素;P为Cu元素,
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,它的外围电子的电子排布图为![]() ,P元素为Cu,Cu属于第IB族元素,在周期表中位于ds区;
,P元素为Cu,Cu属于第IB族元素,在周期表中位于ds区;
(2)SO2分子中S原子价层电子对数=2+(6-2×2)/2=3,S原子含有1对孤电子对,故其立体结构是V型,CO2分子中C原子形成2个![]() 键、没有孤电子对,C的杂化轨道类型为sp杂化, SO2为极性分子, CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
键、没有孤电子对,C的杂化轨道类型为sp杂化, SO2为极性分子, CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)元素Ca与元素F形成晶体,晶胞中绿色球数目![]() 、蓝色球为8个,故化学式为CaF2,该化合物的摩尔质量为Dg/mol,晶胞质量
、蓝色球为8个,故化学式为CaF2,该化合物的摩尔质量为Dg/mol,晶胞质量![]() ,晶胞边长为a pm,则晶胞体积=(a×10-10cm)3=a3×10-30 cm 3,则晶胞密度=
,晶胞边长为a pm,则晶胞体积=(a×10-10cm)3=a3×10-30 cm 3,则晶胞密度=![]() ;
;
(5)三聚氰胺分子中处于环上的N原子成2个![]() 键,有1个孤电子对,采取sp2杂化,氨基中N原子成3个
键,有1个孤电子对,采取sp2杂化,氨基中N原子成3个![]() 键,含有1个孤电子对,N原子采取sp3杂化,单键为
键,含有1个孤电子对,N原子采取sp3杂化,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,故1个三聚氰胺分子含有15个
键,故1个三聚氰胺分子含有15个![]() 键,则1mol三聚氰胺分子中
键,则1mol三聚氰胺分子中![]() 键的数目为15NA;
键的数目为15NA;


科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为发酵粉的成分之一,D的过度排放会造成温室效应。
①B的俗名为_______________。
②反应Ⅰ的离子方程式是_________________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①写出A的一种用途_________________________。
②反应Ⅲ的离子方程式是_________________________________________。
③检验B的溶液中阳离子的方法是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ/mol) | I1 | I2 | I3 | I4 |
X | 578 | 1817 | 2745 | 11578 |
Y | 738 | 1451 | 7733 | 10540 |
X通常显_____价,X的电负性____Y的电负性(填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________。
共价键 | C-C键 | C-N键 | C-S键 |
键能/(kJ/mol) | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ.mol-1) | 786 | 715 | 3401 |
则这四种离子晶体的熔点从高到低的顺序是_______。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2中,适合作录音带磁粉原料的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是

A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
C.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)-
D.pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:

①10.0 g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。 ③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
丙烯酸 | 1420C | 与水互溶,易溶于有机溶剂 | 540C | 有毒 |
甲醇 | 650C | 与水互溶,易溶于有机溶剂 | 110C | 有毒 |
丙烯酸甲酯 | 80.50C | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(注闪点低于500C属于极易燃烧物质)回答下列问题:

(1)仪器c的名称是____________。
(2)混合液用5% Na2CO3溶液洗涤的目的是_____________.
(3)请写出配制100 g 5% Na2CO3溶液所使用的玻璃仪器____________。
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出_____________、________________________.
为检验产率,设计如下实验:
①.油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5 mol/L的KOH溶液10.00 mL,加热使之完全水解。
②.用酚酞做指示剂,向冷却后的溶液中滴加0.5 mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00 mL。
(5)计算本次酯化反应丙烯酸的转化率____。
(6)请列举2条本实验中需要采取的安全防护措施___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铜粉放入硫酸铁溶液中,完全反应后,溶液中的Cu2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是
A.2 :3 B.3 :2 C.2 :5 D.1 :2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为_____________。
的物质的量浓度为_____________。
(2)该研究小组配制该植物培养液时,还须用到的实验仪器是________(填字母)。
A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=____g,m[(NH4)2SO4]=___g。
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是_________(填选项)。
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com