
����Ŀ��A��B��C��D������ѧ��ѧ�г��������ʣ�����A��B��C������ͬһ��Ԫ�أ���һ���������ת����ϵ���£����ַ�Ӧ�е�ˮ����ȥ������������ش��������⣺

��1����A��B��C����ɫ��Ӧ��Ϊ��ɫ��CΪ���ͷ۵ijɷ�֮һ��D�Ĺ����ŷŻ��������ЧӦ��
��B������Ϊ_______________��
����Ӧ�������ӷ���ʽ��_________________________________________��
��2����A��D��Ϊ���ʣ���AΪ���壬DԪ�ص�һ�ֺ���ɫ�����ﳣ�������ϡ�
��д��A��һ����;_________________________��
�ڷ�Ӧ�������ӷ���ʽ��_________________________________________��
�ۼ���B����Һ�������ӵķ�����________________________________________________��
���𰸡�������մ� 2OH�C+CO2=CO32�C+H2O ������Ư�ס������ᡢ��ũҩ����Ư��Һ����Ư�ۺ�Ư�۾�������ҵԭ�ϵ��δ�һ����� 2Fe2++Cl2=2Fe3++2Cl�C ȡ����B����Һ���Թ��У������еμ�KSCN��Һ�������ֺ�ɫ��˵��B�е���������Fe3+
��������
(1)��A��B��C����ɫ��Ӧ��Ϊ��ɫ,������NaԪ��,CΪ�����е���Ʒ,��CΪNaHCO3,D�Ĺ����ŷŻ��������ЧӦ,DΪCO2,A���������̼��Ӧ����B,B���������̼��Ӧ����C,BΪ̼����,��A��C��Ӧ�õ�B,��AΪNaOH��CΪNaHCO3��(2)��A��D��Ϊ����,DԪ�ص�һ�ֺ���ɫ�����ﳣ��������,Fe2O3,��DΪFe,��AΪ����,��ת����ϵ����֪��A����ǿ������,��Fe����Ϊ��̬,����֪AΪCl2��BΪFeCl3��CΪFeCl2��
(1)����������������֪��,B������Ϊ̼��������ˣ�����: ������մ�;
����ӦI��CO2��NaOH��Ӧ,���ӷ���ʽ��: 2OH�C+CO2=CO32�C+H2O ;��˴�: 2OH�C+CO2=CO32�C+H2O ;
(2)��A��D��Ϊ����,DԪ�ص�һ�ֺ���ɫ�����ﳣ��������,Fe2O3,��DΪFe,��AΪ����,��ת����ϵ����֪��A����ǿ������,��Fe����Ϊ��̬,����֪AΪCl2��BΪFeCl3��CΪFeCl2������������AΪCl2��������;�ܶࡣ�磺������Ư�ס������ᡢ��ũҩ����Ư��Һ����Ư�ۺ�Ư�۾�������ҵԭ�ϵȾ������𰸣�������Ư�ס������ᡢ��ũҩ����Ư��Һ����Ư�ۺ�Ư�۾�������ҵԭ�ϵȾ�����
����Ӧ����FeCl2��Cl2�ķ�Ӧ�������ӷ���ʽ��: 2Fe2++Cl2=2Fe3++2Cl�C����˴���: 2Fe2++Cl2=2Fe3++2Cl�C;
��B�к���������ΪFe3+,���鷽����:ȡ����B����Һ���Թ���,�����еμ�KSCN��Һ,�����ֺ�ɫ,˵��B��������ΪFe3+����ˣ�������ȷ����:ȡ����B����Һ���Թ���,�����еμ�KSCN��Һ,�����ֺ�ɫ,˵��B��������ΪFe3+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������У����ж�������ţ�
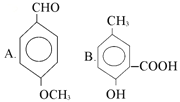
��1�����Կ���������ǣ������ţ���ͬ��________________��
��2�����Կ����������_________________��
��3�����Կ������������_________________��
��4�����Կ����������_________________��
��5�����Կ���ȩ�����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.84 g/cm3�����ʵ���������Ϊ98 %�����ᣬ����250 mL���ʵ���Ũ��Ϊ0.46 mol/L�����ᡣ
(1)98 %��Ũ��������ʵ���Ũ��Ϊ_________��
(2)�������м��ֹ�����Ͳ��Ӧѡ��______������ţ���
��5 mL��Ͳ ��10 mL��Ͳ ��50 mL��Ͳ ��100 mL��Ͳ
(3)ʵ����Ҫ���²��裺
�ٶ��ݢ���ȡ��ҡ�Ȣ�ϴ�Ӣ�ת�Ƣ���ȴ�����װƿ��ϡ�ͽ���˳��Ϊ_______��
(4)���в���ʹ������Һ�����ʵ���Ũ��ƫ�ߵ���__________��
A��������ƿ��ת����Һʱ������Һ�彦��
B��δϴ��ϡ��ŨH2SO4��С�ձ�
C������ʱ���ӿ̶���
D��ϴ������ƿδ���T����������Һ
E�����ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ͼװ�ý���ʵ�飬֤����ͭ��ϡ���ᷴӦ������NO��ʵ��ʱ������ע�����ڼ���һ������ϡ���ᣬ�ž�ע�����ڵĿ�����Ѹ�ٽ�����ͭ˿����Ƥñ���ϣ�һ��ʱ���ע����������ɫ���������

��1��ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ_________________��
��2��NO�Ǵ�����Ⱦ��֮һ��Ŀǰ��һ��������������400�����ҡ��д������ڵ�����£��ð�����NO��ԭΪ������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO![]() 5N2+6H2O��ÿ��5 mol N2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__________��
5N2+6H2O��ÿ��5 mol N2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__________��
��3����������ϡ���ỻ��Ũ���ᣬ�����ɵ�����ͨ��ˮ�У���������ˮ��Ӧ�Ļ�ѧ����ʽΪ______________________________________________��
��4����д��ʵ������NH4Cl��Ca(OH)2������ȡ�����Ļ�ѧ����ʽ__________��
��������Ȫʵ�飬����ˮ�м����̪���õ���ɫ��Ȫ����ʵ�������˰�����������Ҫ���ʷֱ���________________________��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2ͨ��BaCl2��Һ�в�����������������ͼ�Ҳ��Y�ι��з��ú��ʵ�ҩƷ�����к�����������BaCl2��Һ�п��Կ�����ɫ�������Ҳ�Y�ι��зŵ�ҩƷ��( )

A. Cu��Ũ���� B. CaO��Ũ��ˮ
C. Na2SO3�ͽ�Ũ���� D. KMnO4��Һ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����2002��10��26�ն���˹���ֲ����ڽ������ʱ����ʹ���˷�����������̫ū�⣬��������һ���������ñ����ǿ100���ķ��飬��֪����Ļ�ѧʽΪC2HClBrF3����е㲻ͬ������������
A. 3��B. 4��C. 5��D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��Q ��PΪԪ�����ڱ�ǰ�����ڵ�7��Ԫ�ء����У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�Ӻ����L���������K���������Z�ǵؿ��ں�����ߵ�Ԫ�أ�M���ڲ��������������������9����N��ԭ��������MС1, Q��Ԫ�����ڱ��ĸ�Ԫ���е縺�����PԪ�صĵ������Ӳ㴦��ȫ����״̬�����ĵ��Ӳ�ֻ��һ��������ش��������⣺
��1��XԪ�������ڱ��е�λ����_______________��������Χ���ӵĵ����Ų�ͼΪ _______________________________��PԪ������_______��Ԫ�ء�
��2��XZ2���ӵĿռ乹����________ ��YZ2������Y���ӻ��������Ϊ_________ ����ͬ������������ˮ�е��ܽ�Ƚϴ����__________��д����ʽ����������_____________________��
��3������Ԫ��N���ε���ɫ��ӦΪ____ɫ����������ζ����Է�����ɫ��Ӧ����ԭ��________________________
��4��Ԫ��M��Ԫ��Q�γɾ���ṹ��ͼ1��ʾ�����侧���߳�Ϊa pm���û������Ħ������ΪDg/mol����þ����ܶȵļ���ʽΪ_______________g/cm3
��5�������谷��һ�ֺ���������,��ṹ��ʽ��ͼ2��ʾ�� �����谷�����е�ԭ�ӹ���ӻ�������______�� 1 mol�����谷������ ��������ĿΪ______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����Ԫ�ص������������
A. ���������֬����Ԫ����ͬ B. ̼������Ԫ���еĺ���Ԫ��
C. �����ʵ�Ԫ�������̼���⡢���������� D. ��Ȼ����û��һ��Ԫ�������������е�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com