

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
分析 铅蓄电池的正极材料为PbO2,负极为Pb,电解法处理含硝(NO3-)废水时,NO3-在阴极得电子生成氮气,阳极氢氧根离子失电子生成氧气,则Ag-Pt电极为阴极,所以B为负极,A为正极,据电子守恒和原子守恒解答.
解答 解:A、B为负极,A为正极,铅蓄电池的正极材料为PbO2,故A正确;
B、铅蓄电池的负极为铅失电子生成硫酸铅,硫酸铅是难溶电解质,所以负极质量增加,故B正确;
C、NO3-在阴极得电子生成氮气,阴极电极反应式为2NO3-+12H++10e-=N2+6H2O,故C正确;
D、阳极氢氧根离子失电子生成氧气式,阳极电极反应式为4OH--4e-=O2+2H2O,电路中流过2 mol电子,阳极生成0.5mol氧气,所以阳极室溶液质量减少32g/mol×0.5mol=16g,故D错误;
故选D.
点评 本题考查了原电池原理和电解原理的应用,注意根据得失电子来判断阴阳极上发生的反应,注意电子守恒在计算中的应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
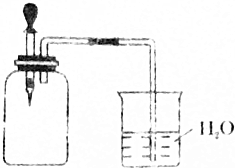 如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.
如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: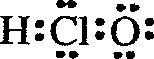 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

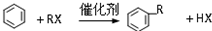 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;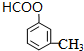 、
、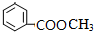 ;
;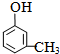 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
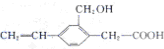
| A. | 该有机化合物的分子式为C11H10O3 | |
| B. | 该有机化合物能发生取代反应、加成反应和加聚反应 | |
| C. | 1mol该有机化合物分别消耗Na、NaOH和NaHCO3的物质的量之比为2:2:1 | |
| D. | 该有机化合物与 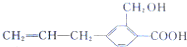 互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| B. | 在恒容密闭容器中充入一定量NO2建立2NO2(g)═N2O4(g)△H<0 平衡后,升高温度,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com