
分析 (1)无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料;
(2)复合材料是由基体和增强体构成,增强体起骨架作用;
(3)依据制备水泥、玻璃用到的原料解答;
(4)铁是重要的金属材料,用铁矿石(主要成分是Fe2O3)冶炼铁是在炼铁高炉中完成的,铁性质较不活泼用热还原法冶炼;
(5)合成高分子材料的小分子叫单体;乙烯聚合生成聚乙烯.
解答 解:(1)a.复合材料不是无机非金属材料,故不选;‘
b.单晶硅是新型无机非金属材料,故选;
c.金刚石是新型无机非金属材料,故选;
d.石墨是新型无机非金属材料,故选;
e.碳-60是新型无机非金属材料,故选;
f.玻璃是传统无机非金属材料,故不选;
故选:b、c、d、e;
(2)撑杆跳项目中运动员使用的撑杆材料是复合材料.这种材料由基体和增强体两部分组成,其中增强体的作用是骨架作用;
故答案为:基体 骨架作用;
(3)石灰石是制备玻璃、水泥等物质的工业原料之一,二者都用到石灰石;
故答案为:石灰石;
(4)铁是重要的金属材料,用铁矿石(主要成分是Fe2O3)冶炼铁是在炼铁高炉中完成的,原理为:在高温下用氧化剂除去生铁中的杂质,再添加其他硅、锰等元素调整其成分;
故答案为:炼铁高炉 在高温下用氧化剂除去生铁中的杂质,再添加其他硅、锰等元素调整其成分;
(5)合成高分子材料的小分子叫单体;聚乙烯车间打算合成4.2×103kg的聚乙烯,则需要投料(乙烯)物质的量为:$\frac{4.2×1{0}^{3}×1{0}^{3}g}{28g/mol}$=1.5×105(mol);
故答案为:单体; 1.5×105.
点评 本题为综合题,考查无机非金属材料、高炉炼铁、合成高分子材料,题目难度不大,掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
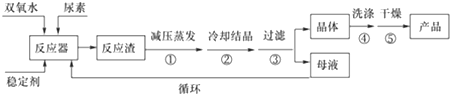
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )| A. | 甲、丙 | B. | 乙、丙 | C. | 甲、丁 | D. | 乙、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
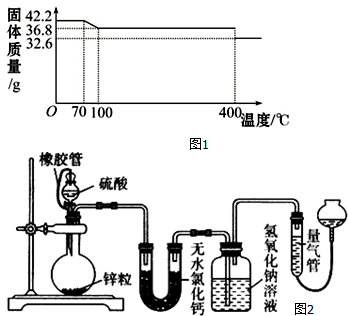
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | H2SO4分子中三种原子均以杂化轨道成键 | |
| D. | N2分子中有一个σ键、2个π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com