
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑分析 (1)有元素化合价变化的反应是氧化还原反应;
(2)氧化还原反应中,可以根据原子守恒来配平化学方程式;
(3)①化合价升高元素所在的产物是氧化产物;
②根据化学方程式和电子转移知识进行计算.
解答 解:(1)反应K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑中,没有元素化合价变化,不是氧化还原反应,故答案为:不是;
(2)在该氧化还原反应中,根据铁元素守恒,所以K4Fe(CN)6前面系数是3,KCN前面系数是12,根据C原子守恒,所以Fe3C前面的系数是1,反应的化学方程式为3K4F(CN)6$\frac{\underline{\;\;△\;\;}}{\;}$12KCN+Fe3C+5C+3N2↑,
故答案为:3;12;1;5;3;
(3)①化合价升高元素是Fe、N和C,所在的产物Fe2(SO4)3、HNO3、CO2是氧化产物,
故答案为:Fe2(SO4)3、HNO3、CO2;
②化合价升高的元素是铁元素、碳元素和氮元素,所以氧化产物是Fe(SO4)3、HNO3、CO2.1mol K4Fe(CN)6在反应中失去电子是(1+2×6+8×6)mol=61mol,所以根据电子的得失守恒可知,消耗高锰酸钾的物质的量为61mol÷5=12.2mol,故答案为:12.2.
点评 本题考查学生氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意从元素化合价的角度解答该题,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

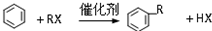 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;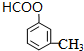 、
、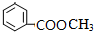 ;
;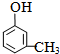 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | >0.1mol/L | B. | <0.1mol/L | C. | 0.1mol/L | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com