
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
分析 A.混合时反应生成碳酸钡沉淀;
B.混合时氢氧化钠不足,反应生成氢氧化铝沉淀B;
C.混合时生成硫酸钡沉淀C;
D.碳酸钠与硫酸正好反应生成二氧化碳气体,没有沉淀生成.
解答 解:A、等物质的量NaOH、NaHCO3恰好反应生成碳酸钠和水,BaCl2和碳酸钠前后反应生成碳酸钡沉淀和氯化钠,所以一定有沉淀生成,故A不选;
B、AlCl3、NH3•H2O、NaOH等物质的量混合,1mol铝离子需要3mol氢氧根离子完全沉淀,根据题意碱不足,所以一定有沉淀生成,故B不选;
C、Ba(OH)2、CaCl2、Na2SO4等物质的量混合可以生成硫酸钡沉淀,所以一定有沉淀生成,故C不选;
D、Na2CO3、MgCl2、H2SO4等物质的量混合能生成沉淀只能是碳酸镁,但有硫酸存在,所以不可能生成沉淀,故D选;
故选D.
点评 本题考查了给定量的物质混合时的反应判断,关键是要充分掌握各类物质的化学性质,生成物质在所在环境中的存在判断,综合性较强需认真分析作答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | H2SO4分子中三种原子均以杂化轨道成键 | |
| D. | N2分子中有一个σ键、2个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
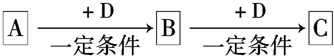
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
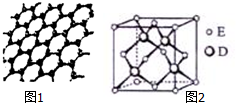 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y、W的最高价含氧酸酸性顺序:Y>W>X | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | X、W形成的化合物XW4属于离子化合物 | |
| D. | 原子半径:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
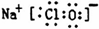 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com