
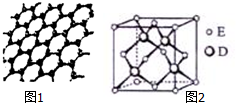
 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:分析 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,C的最外层电子数是次外层电子数的3倍,则C的最外层有6个电子,C为O元素,C与D同主族相邻,则D为S元素;A基态原子的2p轨道上有2个未成对电子,而且A的原子序数比O小,所以A为C元素;B的原子序数介于A、C之间,所以B为N元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn元素;
(1)电子排布为半满状态,较稳定,第一电离能较大;E为Zn元素,Zn的核外有30个电子;
(2)水分子间存在氢键,氢键的作用力大于范德华力;
(3)C形成的单质中层状结构的晶体为石墨,每个C原子形成3个共价单键,所以价层电子对数为3;
(4)根据中心原子的价层电子对数判断;
(5)S在晶胞内部,原子数为4,Zn在顶点和面心,根据均摊法计算;晶胞中处于面心上的Zn原子与2个S原子相连,而该Zn原子被2个晶胞共用;晶胞边长为a,则晶胞的体积为a3,晶胞的质量为$\frac{4×97}{N{\;}_{A}}$,根据ρ=$\frac{m}{V}$计算.
解答 解:原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,C的最外层电子数是次外层电子数的3倍,则C的最外层有6个电子,C为O元素,C与D同主族相邻,则D为S元素;A基态原子的2p轨道上有2个未成对电子,而且A的原子序数比O小,所以A为C元素;B的原子序数介于A、C之间,所以B为N元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn元素,
(1)C、N、O三种元素中,N原子的电子排布为半满状态,较稳定,第一电离能较大,所以第一电离能最大的是N;E为Zn元素,Zn的核外有30个电子,其电子排布式为:1s22s22p63s23p63d104s2;
故答案为:N;1s22s22p63s23p63d104s2;
(2)C、D的简单氢化物分别为H2O、H2S,水分子间存在氢键,其沸点比硫化氢高;
故答案为:H2O;水分子间存在氢键;
(3)A为C元素,C形成的单质中层状结构的晶体,该单质为石墨,每个C原子形成3个共价单键,所以价层电子对数为3,其原子的杂化轨道类型为sp2;
故答案为:sp2;
(4)化合物SO2的中S原子的价层电子对数为:2+$\frac{1}{2}$(6-2×2)=3,含有一个孤电子对,所以立体构型为V形;中心原子的价层电子对数为3;
故答案为:V形;3;
(5)S与Zn形成化合物的晶胞中,S在晶胞内部,原子数为4,Zn在顶点和面心,Zn的原子数为$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,所以其化学式为ZnS;晶胞边长为a,则晶胞的体积为a3,晶胞的质量为$\frac{4×97}{N{\;}_{A}}$,所以晶体E的密度为ρ=$\frac{4×97g/mol}{{a}^{3}{N}_{A}}$;
故答案为:ZnS;$\frac{4×97g/mol}{{a}^{3}{N}_{A}}$.
点评 本题考查了物质结构和性质,涉及电离能、氢键、分子结构、杂化轨道、离子方程式、晶胞结构与计算等,为常考知识点,注意掌握中学常见配合物,晶胞结构需要学生具有一定的空间想象能力,侧重对学生综合能量的考查,难度中等.


科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫代硫酸钠溶液与稀硫酸反应:2S2O32-+4H+═3S↓+SO42-+2H2O | |
| B. | 在K2Cr2O7的溶液中:Cr2O72-+H2O?2 CrO42-+2H+ | |
| C. | 在KI的溶液滴加稀硫酸:4I-+4H++O2═I2+2H2O | |
| D. | 少量的铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g氢气所含原子数目为NA | |
| B. | 1.7g NH3中含N-H键数目为0.1NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
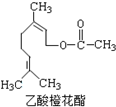 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com