
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种常见无水盐的化学式_____________。
⑵下图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示__________。E与D按原子个数比1﹕1形成的化合物的电子式为_____________________。

⑶人们通常把拆开l mol某化学键所吸收的能量看成该
化学键的键能。键能的大小可以衡量化学键的强弱,也可以
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应
中断裂旧化学键的键能之和与反应中形成新化学键的键能之和
的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):_________。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热:____________________________________。
(1)NaHCO3、CH3COONa (2)氢键 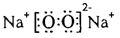
(3) ① a > c > b ②990.7 kJ/mol
【解析】考查元素周期表的结构、晶体的判断及有关反应热的计算。
根据所给元素的性质可判断,A是H,B是C,C是N,D是O,E是Na,F是Si。
(1)只含有H、C、O、Na四种元素的两种常见无水盐分别为碳酸钠和醋酸钠。
(2)H和O形成的常见化合物是水,水中存在氢键,所以虚线表示氢键。Na和O按原子个数比1﹕1形成的化合物是过氧化钠,含有离子键和非极性键。
(3)①a是SiC属于原子晶体,b是CO2,是分子晶体,c是Si,也是原子晶体。因为Si-C的键能大于Si-Si的键能,所以碳化硅的熔点高于硅的,硅的高于CO2的,即a > c > b。
②硅和氧气反应的化学方程式为Si+O2=SiO2,因为1个硅原子形成2个Si-Si,在二氧化硅晶体中1个硅原子形成4个Si-O,所以该反应的燃烧热是2×176 kJ·mol-1+497.3 kJ·mol-1-4×460 kJ·mol-1=990.7 kJ/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
科目:高中化学 来源:2009—2010学年广州市七区联考高一化学下学期期末监测 题型:填空题
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北宜昌金东方学校高二上学期期末考试化学试卷(带解析) 题型:填空题
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
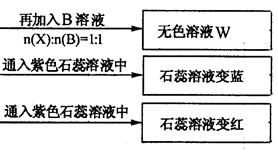
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
查看答案和解析>>
科目:高中化学 来源:2013届湖北宜昌金东方学校高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
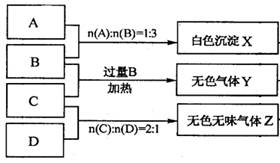
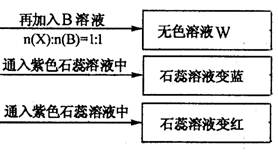
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广州市七区联考高一化学下学期期末监测 题型:填空题
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com