
【题目】向含有1 mol HNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A. b表示Fe3+物质的量的变化线
B. n1=0.8
C. P点时,n(Fe2+)=0.45mol
D. 加入的铁为n3mol时,再向溶液中加入铜粉,铜粉可以溶解
【答案】C
【解析】试题分析:在酸性条件下,铁少量时可以被硝酸根氧化为Fe3+,铁足量后可以把Fe3+还原为Fe2+。由图像可知,a表示Fe3+、b表示Fe2+的变化曲线。n(NO3-)=1mol,n(H+)=3mol。A. b表示Fe3+物质的量的变化线,A不正确;B. 由反应Fe+NO3-+4H+=Fe3++NO↑+2H2O可知,NO3-过量,n1=![]() n(H+)=n(Fe3+)=0.75mol,B不正确;C. 由2Fe3++Fe=3Fe2+可知,P点时,n(Fe2+)= n(Fe3+)=0.75mol-
n(H+)=n(Fe3+)=0.75mol,B不正确;C. 由2Fe3++Fe=3Fe2+可知,P点时,n(Fe2+)= n(Fe3+)=0.75mol-![]() n(Fe2+),所以 n(Fe2+)=0.45mol,C正确;D. 由图像可知,加入的铁为n3mol时,n(Fe3+)=0,再向溶液中加入铜粉,铜粉不溶解,D不正确。本题选C。
n(Fe2+),所以 n(Fe2+)=0.45mol,C正确;D. 由图像可知,加入的铁为n3mol时,n(Fe3+)=0,再向溶液中加入铜粉,铜粉不溶解,D不正确。本题选C。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)除去下列表格物质中的杂质(括号中是杂质),从所给试剂及操作方法中选出合适的药品及方法(填序号):
除杂试剂:A.溴水 B.饱和碳酸钠溶液 C.氢氧化钠溶液 D.乙醇
操作方法:E.蒸馏 F.分液 G.洗气 H.萃取
物质(括号中是杂质) | 除杂试剂 | 操作方法 |
①硝基苯(硝酸) | _____ | _____ |
②乙酸乙酯(乙酸) | _____ | _____ |
③甲烷(乙烯) | _____ | _____ |
(2)①乙酸中官能团的名称是__________________。
②工业上用乙烯水化法制备乙醇,反应的化学方程式是______________。
③红热的铜丝插入乙醇中反复几次发生反应,反应的化学方程式是______________,该反应类型为___________反应。
④丁烷有___________种同分异构体,其中___________(写名称)熔、沸点较低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________。
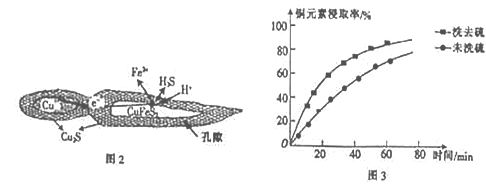
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________。
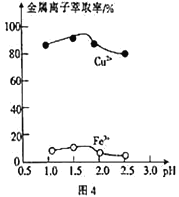
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最后能产生沉淀的是( )
A.向AlCl3溶液中加过量的NaOH溶液
B.向NaAlO2溶液中加过量的盐酸
C.向AlCl3溶液中通入过量的CO2
D.向NaAlO2溶液中通入过量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—)
C. 对应溶液的电导率:a<b<c<d
D. 对应溶液水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:
(1)镓(Ga)价电子排布式为______,镓(Ga)与铟(In)同主族第一电离能较小的为______(用元素符号表示)。
(2)硒属于_______区元素。O、S、Se简单氢化物稳定性由強到弱的顺序为______,中心原子的杂化方式为___________,键角最大的是_____________。
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是__________ (填化学式)。
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为__________。

图中A原子和B原子坐标(分别为(0,0,0),(0,0, ![]() ),则C原子坐标为_________。
),则C原子坐标为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①能量越低的物质就越稳定②白磷转化成红磷是放热反应。据此,下列判断或说法中错误的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的分子结构不同
D.白磷容易发生自燃而红磷则不会自燃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com