
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)。
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1 molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为20.0%。则:
①在该温度下,其平衡常数K=________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率将_______(填“増大”“减小”“不变”或“无法确定”),理由是__________________________________。
③若反应器的体积固定,不同压强下可得变化如下图所示,则压强的关系是____________。

④实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H6(g)+H2(g)。反应器和CH4起始量不変,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如下图所示。
C2H6(g)+H2(g)。反应器和CH4起始量不変,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如下图所示。

I.在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
II.若在400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,其余为CH4和H2,则体系中CH4的体积分数是____________。
【答案】2CH4(g)![]() C2H4(g)+2H2(g)△H=+202.0kJ/mol
C2H4(g)+2H2(g)△H=+202.0kJ/mol ![]() 0.20mol/L 增大 反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大 p1>p2 乙炔 28%
0.20mol/L 增大 反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大 p1>p2 乙炔 28%
【解析】
(1)根据表格中数据书写H2、CH4、C2H4燃烧热的热化学方程式,由盖斯定律计算;
(2)X的分子式C2H4O,不含双键,判断出X的结构简式;
(3)①根据三段式结合平衡混合气体中C2H4的体积分数为20.0%计算;
②通入高温水蒸气,相当于加热和减小压强,根据(2)中的反应并结合平衡的影响因素分析解答;
③若容器体积固定,根据反应的特征结合压强对平衡的影响分析判断;
④由图可知,温度高于600℃时,有较多的自由基![]() 生成;
生成;
(4)设最终气体的总物质的量为x,计算出平衡时C2H4、C2H6和氢气的物质的量,再计算甲烷的体积分数。
(1)根据表格中数据有:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJ/mol,②CH4(g)+2O2(g)
O2(g)═H2O(l)△H1=-285.8kJ/mol,②CH4(g)+2O2(g)
=CO2(g)+2H2O(l)△H2=-890.3kJ/mol,③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=-1411.0kJ/mol
,甲烷制备乙烯的化学方程式为:2CH4(g) ![]() C2H4(g)+2H2(g),根据盖斯定律,将②×2-③-①×2得到,2CH4(g)
C2H4(g)+2H2(g),根据盖斯定律,将②×2-③-①×2得到,2CH4(g) ![]() C2H4(g)+2H2(g) △H=2△H2-△H3-2△H1=+202.0kJ/mol,故答案为:2CH4(g)
C2H4(g)+2H2(g) △H=2△H2-△H3-2△H1=+202.0kJ/mol,故答案为:2CH4(g) ![]() C2H4(g)+2H2(g)△H=+202.0kJ/mol;
C2H4(g)+2H2(g)△H=+202.0kJ/mol;
(2)由题意乙烯与氧气催化制备X,X的分子式C2H4O,不含双键,反应符合最理想的原子经济可知,X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%,由此建立如下三段式:
2CH4(g) ![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起始(mol) 1 0 0
转化(mol) 2x x 2x
平衡(mol) 1-2x x 2x
由平衡混合气体中C2H4的体积分数为20.0%得![]() =20.0%,解得x=0.25,平衡后气体的体积=
=20.0%,解得x=0.25,平衡后气体的体积=![]() ×1L=1.25L,所以化学平衡常数为K=
×1L=1.25L,所以化学平衡常数为K=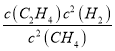 =
=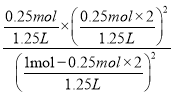 =
=
0.20mol/L,故答案为:0.20mol/L;
②甲烷制备乙烯的反应为气体体积增大的吸热反应,通入高温水蒸气(不参加反应,高于400℃)相当于加热,平衡右移,产率增大;同时通入水蒸气,容器的体积增大,相当于减小压强,平衡右移,产率也增大,因此C2H4的产率将增大,故答案为:增大;该反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大;
③若容器体积固定,甲烷制备乙烯的反应为气体体积增大的反应,温度相同时,增大压强平衡向逆反应方向移动,CH4的平衡转化率降低,因此p1>p2,故答案为:p1>p2;
④由图可知,温度高于600℃时,有较多的自由基![]() 生成,自由基结合生成
生成,自由基结合生成![]() ,则双碳有机副产物为乙炔,故答案为:乙炔;
,则双碳有机副产物为乙炔,故答案为:乙炔;
(4)设最终气体的总物质的量为x,则C2H4为0.2x、C2H6为0.06x,根据2CH4(g) ![]() C2H4(g)+2H2(g)和2CH4(g)
C2H4(g)+2H2(g)和2CH4(g) ![]() C2H6(g)+H2(g)可知,生成的氢气为0.4x+0.06x=0.46x,则含有的甲烷为x-(0.2x+0.06x+0.46x)=0.28x,因此体系中CH4的体积分数=
C2H6(g)+H2(g)可知,生成的氢气为0.4x+0.06x=0.46x,则含有的甲烷为x-(0.2x+0.06x+0.46x)=0.28x,因此体系中CH4的体积分数=![]() ×100%=28%,故答案为:28%。
×100%=28%,故答案为:28%。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下, Al与Fe2O3发生铝热反应后得到的固体混合物中主要含有Al2O3、Fe,还含有少量Fe2O3。从该样品中固体混合物分离出Al2O3,并回收Fe和Fe2O3的流程如下:

已知:NaAlO2 + CO2 + 2H2O = Al(OH)3↓ + NaHCO3
回答下列问题:
(1)固体①的成分是__________。溶液②的溶质是____________。
(2)加入过量NaOH溶液时,发生反应的离子方程式是__________。
(3)白色固体②与NaOH溶液反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
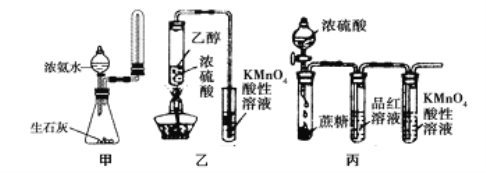
A. 实验室用图甲所示装置制取少量氨气
B. 为使100mL0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50mL水
C. 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2019·福建省厦门市高中毕业班5月第二次质量检查]一种以磷酸工业副产物磷石膏(主要成分为CaSO4,杂质含H3PO4,SiO2,Al2O3等)制取高纯硫酸钙的流程如图所示。
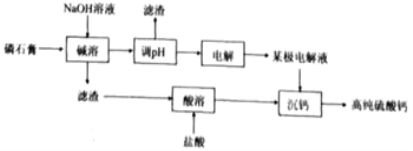
(1)磷石膏废弃会造成的环境问题为___________;
(2)“碱溶”中Al2O3发生反应的化学方程式为_________;
(3)含硅与含铝组分分布系数与pH关系如下图:
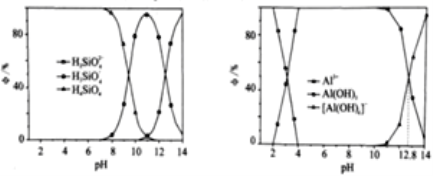
①“调pH”时,溶液的pH应调节为__________;
②Ksp[Al(OH)3]=__________;
③Al(OH)3(aq)+H2O![]() [Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
[Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
(4)“电解”采用双极膜电渗析法,装置如下图。
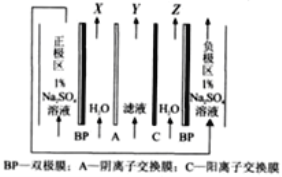
①“某极电解液”为________(填“X”、“Y”或“Z”)极。
②阴极电极反应式为____________。
(5)流程中可循环利用的物质有________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
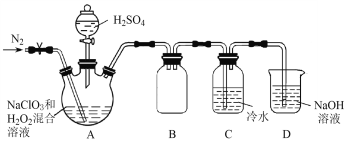
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_______________________________。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________________作指示剂,用0.100 0 mol![]() L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol
L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol![]() L-1。
L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com