
下列说法正确的是 ( )
A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小, 的比值增大
的比值增大
D、室温下,CH3COOH的 的
的 溶液中的c (H+)与NH3·H2O中的c(OH-)相等
溶液中的c (H+)与NH3·H2O中的c(OH-)相等
【知识点】溶液中的平衡、离子浓度关系
【答案解析】C 解析:A、水的离子积KW只与温度有关,外加酸、碱一定会影响水的电离程度,但盐不一定,如NaCl,故A错误;B、Ksp只与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误; C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,铵根水解呈酸性,能使溶液的pH减小, c (NH4+)/ c (NH3·H2O)=Kb/C(OH-),C(OH-)减小,比值增大,故C正确;D、电离常数表达式:Ka= c (H+)·C(CH3COO-)/ c (CH3COOH),Kb= c (NH4+)·C(OH-)/ c (NH3·H2O),不知酸碱浓度是否相等,故D错误。
故答案选C
【思路点拨】本题考查较为综合,涉及电离常数的定性判断和计算、弱电解质的电离、盐类
的水解等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用。


科目:高中化学 来源: 题型:
在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
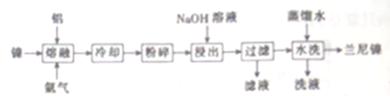
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO3-
D.在含Fe 3+、 H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
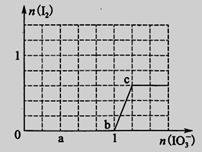
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸( )等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
)等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:

已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:

② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:

已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:

查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示,
①正反应为放热反应,
②反应物总能量低于生成物总能量,
③反应物的总键能小于生成物的总键能,
④1molA与1molB充分反应后,能量变化为ΔE,
⑤加入催化剂后,反应加快,ΔE减小,
⑥反应达到平衡时,升高温度,A的转化率增大,
⑦升高温度可增大正反应速率,降低逆反应速率,
⑧E2是反应C(g)+D(g)  A(g)+B(g) 的活化能,
A(g)+B(g) 的活化能,
以上有关说法正确的是
A.⑤⑥⑦⑧ B.①②③④ C.①③⑤⑦ D.②⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中,在一定条件下发生反应:2A(?)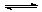 B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
A.若正反应为吸热反应,则A为非气态
B.若正反应为放热反应,则A为气态
C.若在平衡体系中加入少量C,则该平衡不移动
D.压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
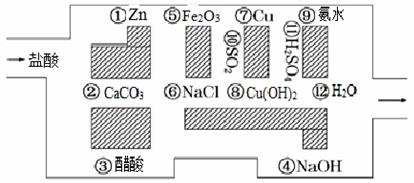
(1)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线)___________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个。
(3)在不能与盐酸反应的物质中,属于非电解质的是________(填写物质序号),在能与盐酸反应的物质中,属于强电解质的是__________(填写物质序号)。
(4)写出物质②的电离方程式
(5)如果将盐酸换成氯化钡,它能沿着盐酸走出的路线“走出”这个迷宫吗?
填“能”或“不能”_____,若不能请写出离子方程式说明其原因:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com