
在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
解析:(1)该反应为放热反应,升高温度,平衡向左移动,平衡常数减小。(2)混合气体的平均相对分子质量为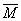 =
=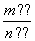 ,平衡向左移动时,
,平衡向左移动时,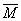 减小,因m(总)不变,则n(总)增大,即2+1>a+1,a=1。(3)该反应为可逆反应,2 mol X和1 mol Y不可能完全反应,所以Q1一定小于Q。(4)该情况考查恒温恒容下的等效平衡状态,A、B、C与题中情况互为等效平衡状态,但B、C实际参加反应的X、Y的量与题中情况不相等,所以放出的热量不为Q kJ,而A中Ar不参与化学反应,对平衡无影响,本题易错选B、C。
减小,因m(总)不变,则n(总)增大,即2+1>a+1,a=1。(3)该反应为可逆反应,2 mol X和1 mol Y不可能完全反应,所以Q1一定小于Q。(4)该情况考查恒温恒容下的等效平衡状态,A、B、C与题中情况互为等效平衡状态,但B、C实际参加反应的X、Y的量与题中情况不相等,所以放出的热量不为Q kJ,而A中Ar不参与化学反应,对平衡无影响,本题易错选B、C。
答案:(1)减小 (2)1 (3)正确 2 mol X和1 mol Y不可能完全反应 (4)A


科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25 ℃时,有关物质的电离平衡常数如下表所示:
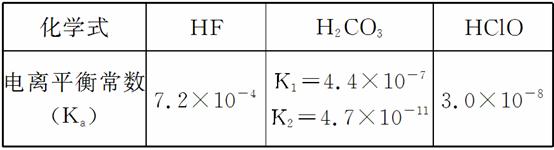
(1)将浓度为0.1 mol·L-1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是________。
A.c(H+) B.c(H+)·c(OH-)
C.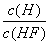 D.
D.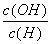
(2)25 ℃时,在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是________。
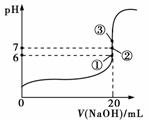
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol·L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol·L-1
(3)物质的量浓度均为0.1 mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。依据数据判断pH由大到小的顺序是__________________。
(4)Na2CO3溶液显碱性是因为CO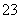 水解的缘故,请设计简单的实验事实证明之__________________。
水解的缘故,请设计简单的实验事实证明之__________________。
(5)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1 mol HF转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
能使反应2Ag+Cu2+===2Ag++Cu发生的是( )
A.用Cu、Ag分别作原电池两电极,AgNO3溶液作电解质溶液
B.用Ag、C分别作原电池电极,CuSO4溶液作电解质溶液
C.用Ag作电解池的阳极,石墨作电解池的阴极,CuSO4溶液作电解质溶液
D.用Ag作电解池的阳极,石墨作电解池的阴极,AgNO3溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒容下,发生如下反应:2A(g)+2B(g)C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2 mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6 mol/L。以下叙述正确的是( )
A.达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率
B.达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C.两途径最终达到平衡时,体系内各组分的百分含量相同
D.两途径最终达到平衡时,体系内各组分的百分含量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
t℃,水的离子积为KW,该温度下将a mol/L一元酸HA与b mol/L一元碱BOH等体积积混合,要使混合液呈中性,必要的条件是( )
A.混合液中c(H+)=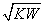
B.混合液的pH=7
C.a=b
D.混合液中c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作能达到实验目的的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 加新制的Cu(OH)2 | 确定尿液中含有葡萄糖 |
| B | 滴加稀溴水 | 确定苯中混有甲苯 |
| C | 加入金属钠 | 确定酒精中混有醋酸 |
| D | 加淀粉 | 确定KCl中含有KI |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 0.1 mol·L-1的NaF溶液中所含F-的数目小于0.1NA
B. 标准状况下,2.24L乙醇中含有的C—H键数目为0.5NA
C. 0.1 molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA
D. 0.1 molO3中含氧原子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小, 的比值增大
的比值增大
D、室温下,CH3COOH的 的
的 溶液中的c (H+)与NH3·H2O中的c(OH-)相等
溶液中的c (H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com