
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 0.1 mol·L-1的NaF溶液中所含F-的数目小于0.1NA
B. 标准状况下,2.24L乙醇中含有的C—H键数目为0.5NA
C. 0.1 molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA
D. 0.1 molO3中含氧原子数目为0.2NA
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
某混合物A含有明矾、Al2O3、CuO,在一定条件下可实现如下图所示的物质之间的转化:
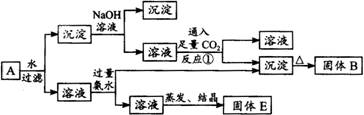
据此判断:
(1)固体B所含物质的化学式为________。
(2)固体E所含物质的化学式为________。
(3)反应①的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、糖类均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是


A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
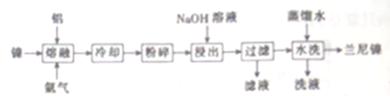
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO3-
D.在含Fe 3+、 H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中,在一定条件下发生反应:2A(?)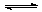 B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
A.若正反应为吸热反应,则A为非气态
B.若正反应为放热反应,则A为气态
C.若在平衡体系中加入少量C,则该平衡不移动
D.压强对该平衡的移动无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com