
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______________、_________________。
实验用品 | 溶液温度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | _______ |
② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | |
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1·kg-1,各物质的密度均为lg·cm-3。计算完成上表。△H=____________
(3)某研究小组将V1mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2 =50mL)。此反应所用NaOH溶液的浓度应为__________mol/L。
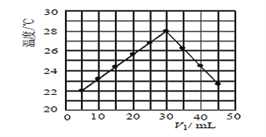
【答案】 量筒 温度计 -56.8kJ/mol 1.5
【解析】本题考查中和热的测定,(1)中和热的测定中需要的仪器是量筒、温度计、口径不同的烧杯、环形玻璃搅拌棒、碎纸条(或泡沫塑料)、硬纸板(或泡沫塑料板),根据题意,缺少的玻璃仪器是量筒和温度计;(2)①温度的变化是(23.3-20)℃=3.3℃,②温度的变化是(23.5-20)℃=3.5℃,平均温度的变化是(3.3+3.5)/2℃=3.4℃,根据△H=- =-
=- kJ·mol-1=-56.8kJ·mol-1;(3)当加入V1=30mL时,温度达到最高,说明HCl和NaOH恰好完全反应,V2=20mL,因此有30×10-3×1=20×10-3×c(NaOH),解得c(NaOH)=1.5mol·L-1。
kJ·mol-1=-56.8kJ·mol-1;(3)当加入V1=30mL时,温度达到最高,说明HCl和NaOH恰好完全反应,V2=20mL,因此有30×10-3×1=20×10-3×c(NaOH),解得c(NaOH)=1.5mol·L-1。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.44gCO2分子中含有的氧分子数为NA
B.标准状况下,11. 2LH2O所含分子数为0.5NA
C.24gMg在足量氧气中完全燃烧失去的电子数为2NA
D.常温常压下,22. 4LN2所含分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似,25℃时,NH3+NH3NH ![]() +NH
+NH ![]() ,NH
,NH ![]() 的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
的平衡浓度为1×10﹣15molL﹣1 , 则下列说法中正确的是( )
A.在液氨中加入NaNH2可使液氨的离子积变大
B.在液氨中加入NH4Cl可使液氨的离子积减小
C.在此温度下液氨的离子积为1×10﹣17
D.在液氨中放入金属钠,可生成NaNH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能( )
①5:1、②9:2、③3:1、④2:1、⑤4:1
A. ②③ B. ①③④ C. ②③⑤ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题: 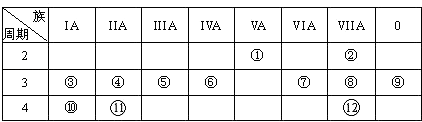
(1)写出下列元素符号:① , ⑥ , ⑦ .
(2)画出原子的结构示意图:④ , ⑧ .
(3)在①~12元素中,金属性最强的元素是 , 非金属性最强的元素是 , 最不活泼的元素是 . (均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 .
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号),它们可以形成(填离子或共价)化合物,用电子式表示其形成过程如下: .
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的一组是( )
①不溶于水的BaSO4是强电解质 ②可溶于水的酸都是强电解质 ③0.5mol/L的所有一元酸中氢离子浓度都是0.5mol/L ④熔融态的电解质都能导电。
A. ①③④ B. ②③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.2mol/L,硫酸根离子的浓度为0.5 mol/L,则混和溶液中镁离子浓度为( )。
A. 0.15 mol/L B. 0.3 mol/L C. 0.45 mol/L D. 0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下: 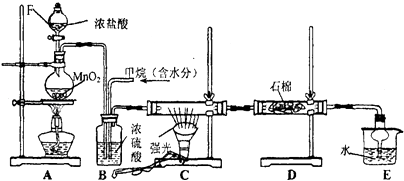
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②;③ .
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是 .
(3)D装置中的石棉上均匀附着KI粉末,其作用是 .
(4)E装置的作用是(填编号).
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 .
(6)装置E中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 , 该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com