
 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:分析 (1)五种物质中NaOH、NH3•H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH3•H2O、D为NaOH;浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH;
(2)B是一水合氨,加水稀释促进一水合氨电离,但其电离增大程度远远小于溶液体积增大程度;
(3)A、E分别是盐酸和醋酸,OH-浓度相同的等体积的两份溶液A和E,说明两种溶液中氢离子浓度也相同,因为醋酸是弱电解质,所以醋酸浓度大于盐酸,体积相同的这两种酸,醋酸物质的量大于盐酸,如果锌有剩余,应该是盐酸中有剩余,反应速率与氢离子浓度成正比;
(4)将等体积、等物质的量浓度B和C混合后溶液,二者恰好完全反应生成硫酸铵,升高温度促进硫酸铵水解导致其pH减小;
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,溶液中溶质为硫酸钠、硫酸铵和一水合氨,结合电荷守恒判断离子浓度大小.
解答 解:(1)五种物质中NaOH、NH3•H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH 3•H2O、D为NaOH;浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH.
故答案为:NaOH;
(2)①由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,则$\frac{c(N{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$=$\frac{n(N{H}_{3}.{H}_{2}O)}{n(O{H}^{-})}$减小,故①正确;
②由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,c(NH3•H2O)、c(OH-)都减小,c(H+)减小,则$\frac{c(O{H}^{-})}{c({H}^{+})}$减小,故②正确;
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④由NH3•H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;
②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;
③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;
④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;
⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;
⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;
故答案为:③④⑤;
(4)等体积、等物质的量浓度NH3•H2O和与NH4HSO4混合后溶液发生反应:NH3•H2O+NH4HSO4=(NH4)2SO4+H2O,NH4)2SO4要发生水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,故答案为:④;
(5)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3•H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+)>c(OH-)=c(H+);
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查无机物推断及弱电解质的电离,为高频考点,涉及离子浓度大小比较、弱电解质电离特点、反应速率影响因素等知识点,明确物质性质及溶液中溶质成分是解本题关键,难点是(5)题离子浓度大小比较,注意酸与金属反应速率有氢离子浓度有关,与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| B. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| C. | 用SO2漂白过的草帽缏日久会变色 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W溶液显碱性或中性 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
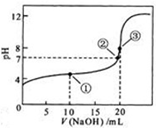
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),当pH=7时,溶液中的酸恰好完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
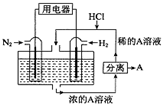 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com