
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
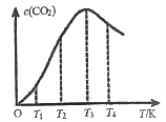
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】BC放热40%0.02a mol·min-1
【解析】
①A.CO和CO2的浓度之比为1:1,可能是反应进行到某一时刻的情况,不一定是平衡状态,故A不能判断该反应达到化学平衡状态;
B.CO和CO2的物质的量之比不再变化,说明各物质的浓度保持不变,故B能判断该反应达到化学平衡状态;
C.此反应是反应前后气体体积改变的反应,反应体系中有固体物质,气体总物质的量也发生改变,当容器内混合气体的平均摩尔质量不再变化,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D.形成amolC=O键,即生成![]() molCO2,为正反应;断裂amolC
molCO2,为正反应;断裂amolC![]() O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
故答案为:BC;
②T3对应的点为刚达到平衡点,T3对应的点后为平衡受温度影响的情况,即升温,CO2的物质的量浓度c(CO2)减小,平衡左移,故正反应的![]() H<0,则该反应为放热反应。
H<0,则该反应为放热反应。
故答案为:放热;
③设转化的CO的物质的量为xmol,则:
2CO(g)![]() C(s)+CO2(g)
C(s)+CO2(g)
起始(mol) a 0 0
变化(mol) x ![]()
![]()
平衡(mol) a-x ![]()
![]()
依据题意有,![]() 100%=75%,解得:x=0.4a。
100%=75%,解得:x=0.4a。
CO的平衡转化率为:![]() 100%=
100%=![]() 100%= 40%;
100%= 40%;
0-10min内平均反应速率v(CO2)=![]() =
=![]() = 0.02a mol·min-1。
= 0.02a mol·min-1。
故答案为:40%;0.02a mol·min-1。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】NaAlH4(四氢铝钠)是有机合成的重要还原剂。某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3,MgO和SiO2、等杂质制备四氢铝钠的工艺流程如下:

资料显示:NaH、NaAlH4遇水蒸气发生剧烈反应。
请回答下列问题:
(1) NaAlH4中氢元素的化合价为___________。
(2)试剂A中溶质的阴、阳离子所含电子数相等,其电子式为___________。在空气中灼烧滤渣2,得到的固体的主要成分为___________(填化学式)。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式:___________。
(4)实验前要保证NaH与AlC13反应的装置干燥,其目的是___________________。
(5)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图所示。当硫酸浓度大于 C0 mol·L-1时,浸出率降低的原因可能是___________。

(6)测定NaAlH4粗产品的纯度。
称取 m g NaAlH4粗产品按如图所示装置进行实验,测定产品的纯度。
①“安全漏斗”中“安全”的含义是____________________________________________。
②已知实验前B管读数为xmL,向A中加入足量蒸馏水,当A中反应完全后,冷却至室温B管读数为ymL(均折合成标准状况)。则该产品的纯度为___________(用含m、x和y的代数式表示)。
③若实验前读数时B管和C管液面相平,实验后读数时B管液面低于C管,则测得的结果___________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:____________________________________________。
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为_________________________________。
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。
①下列措施有利于提高反应物转化率的是___________(填序号)。
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为_________________________________。

③已知:CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-1
1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=________________。
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是______________________。
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___________。
CH3OH(g)的平衡常数K=___________。
(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8kJ/mol,
则由石墨生成甲烷的反应热:C(石墨)+2H2(g)=CH4(g) ΔH 4= _________________。
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m________n(填>、<、= )
(3)常温下,某一元酸HA的Ka=2×10-6,则0.5 mol/L该酸溶液的PH =______。
(4)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯气能用来制取漂白粉
B.利用钠的强还原性,可置换出CuCl2稀溶液中的金属Cu
C.MgO的熔点很高,可用耐高温材料
D.高纯硅用来制造电脑芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Br+H2![]() HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
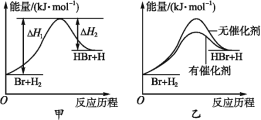
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作不正确的是( )
A.容量瓶用蒸馏水洗涤后须烘干才能使用
B.可以用10 mL量筒量取8.0 mL稀硫酸
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D.蒸馏操作时先通冷却水再加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都是非金属氧化物
(____)两种物质都是钠的化合物
(____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com