
 工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%. 分析 由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=$\frac{5}{4}$,结合实际生产中平衡移动原理来解答.
解答 解:由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=$\frac{5}{4}$=1.25;由图可知,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%,
故答案为:1.25;O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
点评 本题考查化化学平衡的调控作用,为基础性习题,把握发生的反应及图象分析为解答的关键,侧重分析与应用能力的考查,注意理论生产与实际生产的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
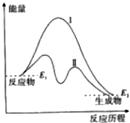
| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
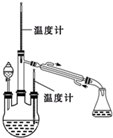 肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:解答题
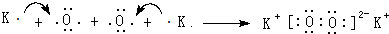 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 增大反应物浓度,能增大活化分子百分数,所以反应速率增大 | |
| C. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| D. | 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
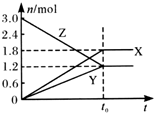 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com