
【题目】根据图示内容填空:
(1)化合物A含有的官能团为。
(2)1molA与2molH2反应生成1molE,其反应方程式为。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的碳链不含支链,其结构简式是。
(5)F的结构简式是。由E→F的反应类型是。
科目:高中化学 来源: 题型:
【题目】面对全球近期的气候异常,环境问题再次成为焦点.化工厂以及汽车尾气排放的二氧化硫、一氧化碳、氮氧化物(NOx)等气体已成为大气污染的主要因素.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3g). 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.
2SO3g). 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 .
②平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置,取决于该元素的( )
A. 最外层电子数和原子量B. 原子量和核外电子数
C. 次外层电子数和电子层数D. 电子层数和最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。
回答下列问题:
(1)A的化学名称为;
(2)由B生成C的化学反应方程式为 , 该反应的类型为;
(3)D的结构简式为;
(4)F的分子式为;
(5)G的结构简式为;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示. 
(1)KC1O2可用于消毒、漂白,是由于其具有性.
(2)Ⅱ中反应生成气体a为 , 1mol双氧水反应转移电子为
(3)A的化学式是 H2SO4 , 装置Ⅲ中发生电化学反应方程式为;pH降低的一端为 (填“阴极”或“阳极”).
(4)C1O2可以用KClO3与草酸在强酸条件下制备,其反应离子方程式为;
(5)取31.95g KC1O2试样配成溶液,其与足量FeSO4溶液反应;消耗Fe2+的物质的量为 , KClO2变质可分解为KC1O3和KCl,取等质量变质后的KC1O2试样配成溶液,再与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”、“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H1
2NO(g)+O2(g)2NO2(g)△H2
NO2(g)+SO2(g)SO3(g)+NO(g)△H3
则△H3= (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3 , 则K3=(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)2NO2(g)[不考虑2NO2(g)N2O4(g)],起始时A、B 的体积相同均为a L. 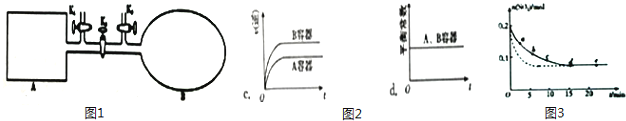
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是 .
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10﹣2(kPa)﹣1 . 若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为 . (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab段平均反应速率(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为 .
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com