
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
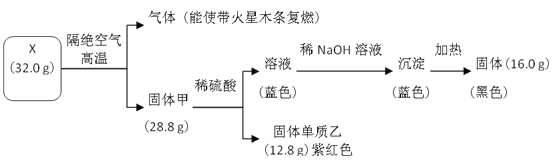
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
【答案】 CuO Cu2++2OH-=Cu(OH)2 Cu2O+H2SO4===Cu+CuSO4+H2O
【解析】流程中32gX隔绝空气加热分解放出了能使带火星的木条复燃的气体为氧气,质量=32.0g-28.8g=3.2g,证明X中含氧元素,28.8g固体甲和稀硫酸溶液反应生成蓝色溶液,说明含铜离子,证明固体甲中含铜元素,即X中含铜元素,铜元素和氧元素形成的黑色固体为CuO,X为氧化铜,n(CuO)=![]() =0.4mol,结合质量守恒得到n(O2)=
=0.4mol,结合质量守恒得到n(O2)=![]() =0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.4mol:(0.4mol-0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜。
=0.1mol,氧元素守恒得到甲中n(Cu):n(O)=0.4mol:(0.4mol-0.1mol×2)=2:1,固体甲化学式为Cu2O,固体乙为Cu,蓝色溶液为硫酸铜,加入氢氧化钠溶液生成氢氧化铜沉淀,加热分解得到16.0g氧化铜。
(1)分析可知X为CuO,故答案为:CuO;
(2)蓝色溶液为硫酸铜溶液,转化为蓝色沉淀氢氧化铜的离子方程式为Cu2++2OH-=Cu(OH)2,故答案为:Cu2++2OH-=Cu(OH)2;
(3)固体甲为Cu2O,氧化亚铜和稀硫酸溶液发生歧化反应生成铜、二价铜离子和水,反应的化学方程式为:Cu2O+H2SO4===Cu+CuSO4+H2O,故答案为:Cu2O+H2SO4===Cu+CuSO4+H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O
B.氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH﹣→CH2ClCOO﹣+H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH﹣ ![]() CH3COO﹣+NH4++3NH3+2Ag↓+H2O
CH3COO﹣+NH4++3NH3+2Ag↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来科学家制造出大量的新物质,对下列三种物质的相关说法错误的是( )
|
|
|
石墨烯:从石墨中分离出来,是最薄、最坚硬的纳米材料 | 石墨炔:平面网状结构的全碳分子,具有优良的化学稳定性 | 纳米碳管:具有优良的场发射性能,制作成阴极显示管、储氢材料 |
A. 石墨烯具有良好的导电性
B. 上述三种物质与金刚石互为同素异形体
C. 石墨炔孔径略大于H2分子的直径,可作H2的提纯薄膜
D. 上述三种物质与浓硫酸都能发生反应,但反应产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量Mg与100mL4mol/L的盐酸反应,固体全部溶解后再加入2mol/L的NaOH溶液,生成沉淀最多时至少需加入氢氧化钠溶液体积为
A. 200mL B. 250mL C. 300mL D. 400mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式或离子方程式(若是离子反应,则写出离子方程式,若不是离子反应,则写出化学方程式)。
(1)铝和氢氧化钠溶液反应:_____________;
(2)实验室制氯气: _____________;
(3)实验室制氨气: _____________;
(4)铜和浓硝酸反应: _____________;
(5)二氧化硫催化氧化: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钾(![]() )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
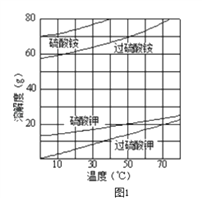
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液.写出电解时发生反应的离子方程式________________________.
(2)已知相关物质的溶解度曲线如图1所示.在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,__________________________,干燥.
(3)样品中过硫酸钾的含量可用碘量法进行测定.实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30mL水溶解.
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30min.
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000molL﹣1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL.(已知反应:I2+2S2O32﹣=2I﹣+S4O62﹣)
①若步骤2中未将碘量瓶“在暗处放置30min”,立即进行步骤3,则测定的结果可能_______(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是_________.
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______.
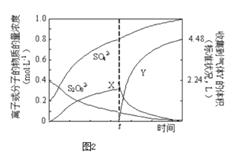
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图2所示(H+浓度未画出).图中物质X的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com