
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_____ ____。
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 乙烯(二氧化硫) | 溴水 | 洗气 |
| B | 溴苯(溴) | NaOH溶液 | 分液 |
| C | 苯(苯酚) | 加浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B.1∶3 C.1∶4 D.2∶3
1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤Ba2SO4固体 ⑥纯蔗糖(C12H22O11) ⑦酒精(C2 H5OH) ⑧熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是___________。
(2)以上物质中属于电解质的是__________。
(3)以上物质中属于非电解质的是__________。
(4)以上物质中溶于水后形成的水溶液能导电的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
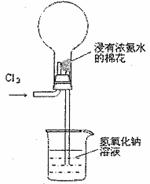 D.烧杯中的溶液是为了吸收有害气体
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
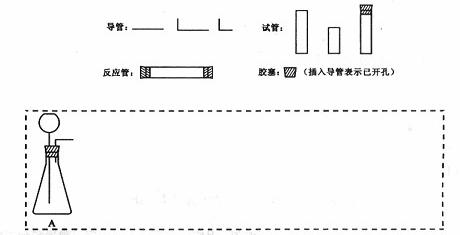
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
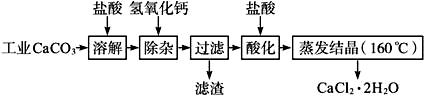
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有____________________;____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:

(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com