
除去下列物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 乙烯(二氧化硫) | 溴水 | 洗气 |
| B | 溴苯(溴) | NaOH溶液 | 分液 |
| C | 苯(苯酚) | 加浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3 NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均为0.2 NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3 === 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”对化学反应提出了“原子经济性”(原子节约) 的概念及要求。理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合“原子经济性”的是 ( )
A. 乙醇催化氧化制乙醛 B.乙醇与浓硫酸共热制乙烯
C.苯乙烯在一定条件下制聚苯乙烯 D.乙烷与氯气反应制氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3 + OH-—→ CH3COO- + CH3CH2O- + H2O
B.醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2 —→ Cu2++2H2O
C.苯酚钠溶液中通入少量二氧化碳:2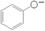 +CO2+H2O
+CO2+H2O 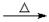 2
2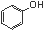 +CO
+CO
D.乙醛溶液与新制氢氧化铜悬浊液共热CH3CHO+2Cu(OH)2+OH_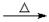 CH3COO-+ Cu2O↓+ 3H2O
CH3COO-+ Cu2O↓+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴某烯烃与H2发生加成反应后得到的产物是CH3—CH(CH3)2.该产物的名称是 ;原来烯烃的结构简式为: ;
(2)今有化合物:

① 请写出化合物丙中官能团的名称: 。
② 请判别上述化合物互为同分异构体的是: 。
③ 请按酸性由强至弱排列甲、乙、丙的顺序: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热(kJ·mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
*燃烧热:1摩尔物质完全燃烧,生成二氧化碳、液态水时所放出的热量
根据表中数据,下列判断错误的是( )。
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
查看答案和解析>>
科目:高中化学 来源: 题型:
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃 烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_____ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com