
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃 烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
【答案】
(1)P2O3 P2O5 2.75 3.55
(2)-(20X-Y)kJ/mol
(3)P(s)+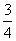 O2(g)=
O2(g)= P2O2(s);
P2O2(s); △H=-(20X-Y)kJ/mol
△H=-(20X-Y)kJ/mol
【解析】3.1 g P在3.2 g O2中充分燃烧后,产物中n(P)∶n(O)=1∶2,可知其中必然有P2O5,另一种固态氧化物为P2O3。列出方程组:
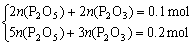
解得:n(P2O5)=0.025 mol,n(P2O3)=0.025 mol,质量分别为3.55 g和2.75 g。
P的燃烧热是1 mol P充分燃烧生成P2O5时放出的热量,则1 mol P与O2反应生成固态P2O3时放出的热量为: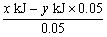 =(20x-y) kJ,即反应热ΔH=-(20x-y)kJ·mol-1。
=(20x-y) kJ,即反应热ΔH=-(20x-y)kJ·mol-1。
热化学方程式为:P(s)+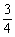 O2(g)====
O2(g)====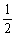 P2O3(s);ΔH=-(20x-y)kJ·mol-1
P2O3(s);ΔH=-(20x-y)kJ·mol-1


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
由苯、乙醛和乙二醇组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量分数为
A.6% B.19.6% C.22% D .24.9%
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 乙烯(二氧化硫) | 溴水 | 洗气 |
| B | 溴苯(溴) | NaOH溶液 | 分液 |
| C | 苯(苯酚) | 加浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)+2878kJ
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)+2869kJ
下列说法正确的是
A 正丁烷分子储存的能量大于异丁烷分子
B 正丁烷的稳定性大于异丁烷
C 异丁烷转化为正丁烷的过程是一个放热过程
D 异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)==CO2(g);△H1 C(s)+ O2(g)==CO(g);△H2
O2(g)==CO(g);△H2
②S(s)+O2(g)==SO2(g);△H3 S(g)+O2(g)==SO2(g);△H4
③H2(g)+ O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1
C.-330kJ·mol-1 D.+330kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B.1∶3 C.1∶4 D.2∶3
1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
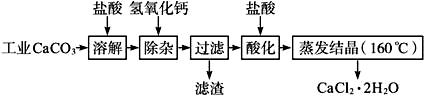
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有____________________;____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com