
[化学——选修2:化学与技术](14分)
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
(一)布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
(二)氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
(三)候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)相比另外两种方法,布兰制碱法工艺的缺点除了成本较高,生成CO和CaS等污染物外还有__________________________和_____________________________(写两点)。
(2)氨碱法工艺的中循环利用的物质是_________(填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式 。
(3)候氏制碱法反应的方程式为____________________________________________。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是__________________________________________________(写一点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为:___________________________。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则( )
A.分子中可能含有氧原子 B.分子中C、H个数之比为1:2
C.分子中C、H、O个数之比为1:2:3 D.此有机物的最简式为为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
溴苯是一种常用的化工原料。实验室制备溴苯
的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL
液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
 步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)仪器d的作用是 。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是 。
(3)仪器c的作用是冷凝回流,回流的主要物质有 (填化学式)。
(4)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.若X2、Y2、XY3改按0、0、2投料,则达到平衡时吸热46.3KJ
D.若容器①体积改为1.0 L.则达平衡时放出的热量小于46.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:





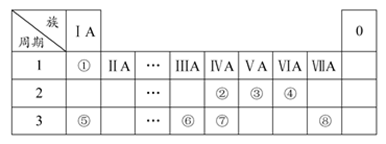
(1) ②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2) 写出由④⑤两种元素组成的既含离子键、又含非极性共价键的化合物的电子式 。
(3) ①、④两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将
Fe2+氧化,写出该反应的离子方程式 。
(4) ①③⑧可组成一种化合物,其原子个数之比为4︰1︰1。该化合物的化学式为_________,该化合物的水溶液显酸性,用离子方程式表示其显酸性的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH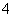 NO
NO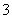 CO
CO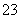 Na+ B.Na+ Ba2+ Mg2+ HCO
Na+ B.Na+ Ba2+ Mg2+ HCO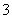
C.NO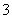 K+ AlO
K+ AlO OH- D.NO
OH- D.NO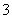 Mg2+ K+ Cl-
Mg2+ K+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
有如图所示A~F六种仪器:
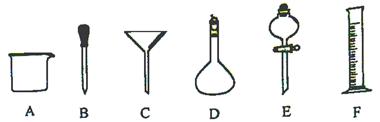
(1)写出仪器名称:D ,E ;
(2)请举例说出仪器A的用途(两种或两种以上) ;
(3)实验室配制一定物质的量浓度的盐酸,需用36.5%的浓盐酸4.5mL。取用4.5mL盐酸时,需要到上图仪器中的F和 (填编号);
(4)下列实验操作中用到仪器C的是 (选填下列选项的字母编号)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
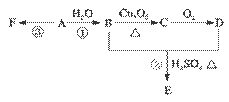
(1)A的分子式为________________。
(2)写出:反应①的化学方程式:__________;该反应的类型是_______________。
反应③的化学方程式: _________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
_____________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com