
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1 S(s )+2K(s)===K2S(s) ΔH2=b kJ·mol-1
)+2K(s)===K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1 则x为( )
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
已知:2Fe + 3Br2=2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:填空题
工业上制取硝酸铵的流程图如图1,请回答下列问题:
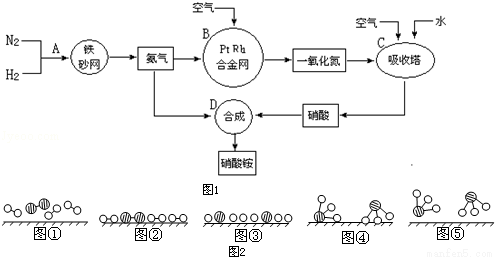
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。
1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程。示意图如图2: 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨气还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
注意事项 理由
①
②
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是
A.若B(OH)m 是强碱,则A(OH)m一定为强碱
B.若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸
C.若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属
D.若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
将足量的CO2不断通入KOH、BA(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
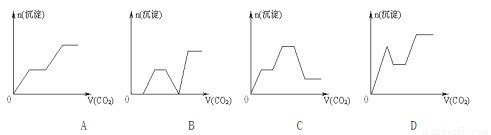
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:计算题
(1)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为__mol,生成1 mol Cu3P时,参加反应的P的物质的量为_____mol
(2)将0?2 mol KMnO4在一定温度下加热后生成a mol O2(a≠0);将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的取值范围为________ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为
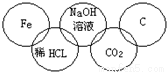
A.分解反应、2个
B.化合反应、3个
C.复分解反应、1个
D.置换反应、2个
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:简答题
已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B。其转化关系如图所示:

(1)将B中所含元素填写在下表的恰当位置中(用元素符号表示)

(2)已知反应 一是放热反应,画出能量关系示意图。
一是放热反应,画出能量关系示意图。

(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和______________。
(4)方法一的化学方程式是_________________。
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是______(填“方
法一”或“方法二”),理由是______________。
查看答案和解析>>
科目:高中化学 来源:2016届新疆兵团农二师华山中学高三上学期第二次月考化学试卷(解析版) 题型:实验题
本题包含三部分.请分别作答:
Ⅰ(1)下列实验方法合理的是____________。
A.用加热法除去食盐固体中的氯化铵
B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C.实验室制取Al(OH)3:往AlCl3溶液中加入NaOH溶液至过量
D.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)将10.7 g氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是____________L。
Ⅱ.工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g。已知NaNO2能发生如下反应:aNO2-+xI-+yH+=bNO↑+cI2+zH2O,请回答下列问题:
(1)上述反应中,x、y、z的数值分别是 (全对才给分)。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
Ⅲ.向炭粉、Cu和Fe2O3组成的混合粉末中加入一定量的稀硫酸,充分反应后过滤,得到溶液A,将沉淀物洗涤、干燥,得到固体B。
(1)碳的原子结构示意图为 ,氧元素在周期中的位置是 。
(2)关于固体B的成分,下列选项中可能的有 。
A 炭粉 B 炭粉和Cu C 炭粉和Fe2O3 D Cu和Fe2O3 E 炭粉、Cu和Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com