分析:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为:18g-9.6g=8.4g,生成NO的体积为:4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为:
=0.15mol,参加反应金属的平均摩尔质量为:
=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算硝酸的物质的量、参加反应Fe的物质的量,根据c=
计算硝酸的物质的量浓度,根据m=nM计算参加反应Fe的质量;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为:6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
=0.15mol,Cu的质量为:0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nV
m计算该阶段生成NO的体积,进而计算V的值.
解答:
解:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为:
=0.15mol,参加反应金属的平均摩尔质量为:
=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量为:
=0.15mol,Cu的质量为:0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
A.由分析可知,实验①发生反应3Fe+8HNO
3═3Fe(NO
3)
2+2NO↑+4H
2O,生成NO的物质的量为:
=0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.1mol×4=0.4mol,故硝酸的物质的量浓度为:
=4mol/L,故A错误;
B.由分析可知,实验①发生反应3Fe+8HNO
3═3Fe(NO
3)
2+2NO↑+4H
2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的Fe的物质的量为0.1mol×
=0.15mol,故参加反应Fe的质量为:0.15mol×56g/mol=8.4g,故B错误;
C.由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,故C错误;
D.由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量为:
=0.2mol,由3Fe+8HNO
3═3Fe(NO
3)
2+2NO↑+4H
2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量为:
=0.1mol,故生成NO的体积为:0.1mol×22.4L/mol=2.24L=2240mL,故V=6720+2240=8960,故D正确;
故选D.



 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案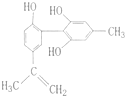 2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法错误的是( )
2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法错误的是( )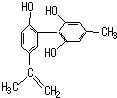 坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法不正确的是( )
坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图所示,有关该物质及其溶液的说法不正确的是( )