
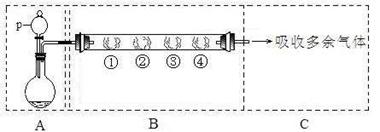
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
| 现象 | 变红(1分) | | 褪色(1分) |
| 体现SO2的性质 | | 漂白性(1分) | 还原性(1分) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.0.5 mol/L | B.0.05 mol/L | C.1 mol/L | D.0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。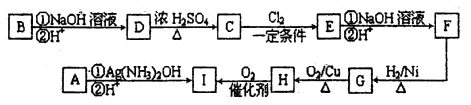
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
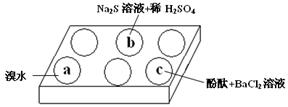
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
| n(SO32—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.①②③ | C.②③ | D.②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com