

分析 (1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;
(2)实验室制取气体要考虑操作方便、易控制、不能含杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)二氧化硫与铁离子反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应中铁离子被氧化成亚铁离子,所以还原产物为亚铁离子;氧化产物是SO42-,SO2气体还原Fe3+反应的产物是Fe2+、SO42-,参加反应的SO2和 Fe3+的物质的量之比是1:2,
故答案为:Fe2+;SO42-;1:2;
(2)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B.浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C.固体硫在纯氧中燃烧,操作不容易控制,且无法获得纯净的二氧化硫,故C错误;
D.Cu与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,可知制备二氧化硫,故D正确;
故答案为:BD;
(3)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:除去多余的SO2,防止污染大气;
(4)从溶液中获得晶体的操作为:蒸发、冷却结晶、过滤、自然干燥;蒸发用蒸发皿和玻璃杯,过滤用漏斗、烧杯、玻璃棒,所以在这一系列操作中没有用到的仪器有石棉网和坩埚;
故答案为:过滤;BF;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以方案①不合理,
故答案为:方案①;因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,其反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-;
故答案为:装置B中溶液蓝色褪去.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化性还原性强弱比较、性质实验方案的设计与评价等知识,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.


科目:高中化学 来源: 题型:解答题
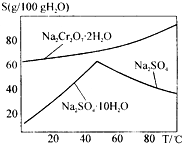 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子组成相差若干个CH2的两种有机物互为同系物 | |
| C. | 分子式相同的不同有机物一定是同分异构体 | |
| D. | 符合通式CnH2n+2的不同烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10gH2 和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.75molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶于1 L 水中可得1 mol•L-1的NaCl溶液 | |
| B. | 将标准状况下22.4 L HCl溶于1 L 水中可得1 mol•L-1盐酸 | |
| C. | 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液中溶质的物质的量浓度为1 mol•L-1 | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液,其物质的量浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | KAl(SO4)2 | C. | NaHCO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2中的Si的化合价为+4 | B. | 起保鲜作用的物质是酒精 | ||
| C. | 该保鲜剂不能与明火接触 | D. | 酒精挥发时分子体积变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com