
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
【答案】D
【解析】
试题分析:A、能与NaOH溶液反应说明是酯类或羧酸,C4H8O2属于羧酸时,可以是丁酸或2-甲基丙酸,共有2种同分异构体;C4H8O2属于酯类的同分异构体,为饱和一元酯,若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种(正丙醇和异丙醇),形成的酯有2种,若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种,若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,所以C4H8O2属于酯类的同分异构体共有4种,A正确;B、存在分子中含有六元环的同分异构体,如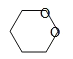 ,B正确;C、C4H8O2属于羟基醛时,可以是2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3羟基丙醛,共5种同分异构体,C正确;D、分子中可以存在含有2个羟基的同分异构体,令人HOCH2CH=CHCH2OH,D错误;答案选D。
,B正确;C、C4H8O2属于羟基醛时,可以是2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3羟基丙醛,共5种同分异构体,C正确;D、分子中可以存在含有2个羟基的同分异构体,令人HOCH2CH=CHCH2OH,D错误;答案选D。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前最主要的温室气体,减小CO2的排放并用来制造有价值的化学用品是目前的研究目标。
(1)利用CO2与CH4生产合成气(CO、H2):
已知:CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.0 KJ·mol-1
2CO2(g) ΔH=-566.0 KJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ΔH= ____________。
2CO(g)+2H2(g) ΔH= ____________。
②250℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,开始发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=________________。
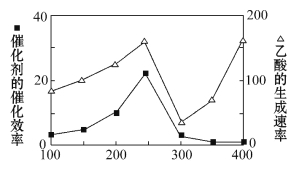
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的可能原因是____________________。
(3) 如以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为_____________________。
(4)将2mol CO2和6molH2容积相同而温度不同的Ⅰ、Ⅱ两个恒容密闭容器中开始发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_______KⅡ(填“>”“=”或“<”),可知该 反应是一个_______(填“放热”或“吸热”)反应。
②下列事实说明该反应已达到平衡状态的是_________________:
A.容器内气体压强保持不变
B.容器内气体的密度保持不变
C.CO2的体积分数保持不变
D.CO2的消耗速率与CH3OH的生成速率相等
E.容器内混合气体的平均相对分子质量保持不变
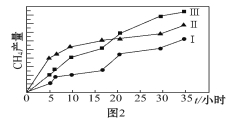
(5)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如上图2所示。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是( )
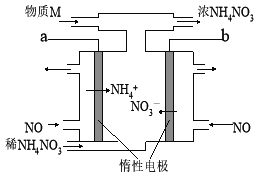
A.a应接直流电源的正极
B.阳极的电极反应式:NO+5e-+6H+=NH4++H2O
C.电路中通过5mol电子时,理论上最可处理22.4L标况下的NO
D.补充的物质M是NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5依次发生的分解反应为:
①N2O5(g)![]() N2O3(g)+O2(g)
N2O3(g)+O2(g)
②N2O3(g)![]() N2O(g)+O2(g)
N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5 (g),加热到t℃,达到平衡状态后,O2为9mol, N2O3 为3.4mol,则t‘C时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜袋中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是( )
A.加入BaCl2溶液不产生白色沉淀
B.加入碘水不变蓝
C.加入BaCl2溶液没有白色沉淀产生
D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
A | B | C | D | |
酸 | H3PO4 | CH3COOH | NaHSO4 | HNO3 |
碱 | Mg(OH)Cl | NaOH | Fe(OH)3 | KOH |
盐 | CuSO45H2O | BaSO4 | NaH2PO4 | Na2S |
氧化物 | H2O | KClO3 | CuO | H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.冰醋酸和乙酸乙酯的混合物可用乙醇萃取分离
B.直链烷烃分子中碳原子数越多其沸点越低
C.同分异构体的物理性质有一定差异,化学性质基本相同
D.由于碳碳双键不能旋转导致分子中的原子在空间的排列方式不同所产生的异构叫顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com