
【题目】下表中物质的分类组合完全正确的是
A | B | C | D | |
酸 | H3PO4 | CH3COOH | NaHSO4 | HNO3 |
碱 | Mg(OH)Cl | NaOH | Fe(OH)3 | KOH |
盐 | CuSO45H2O | BaSO4 | NaH2PO4 | Na2S |
氧化物 | H2O | KClO3 | CuO | H2O2 |
科目:高中化学 来源: 题型:
【题目】
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
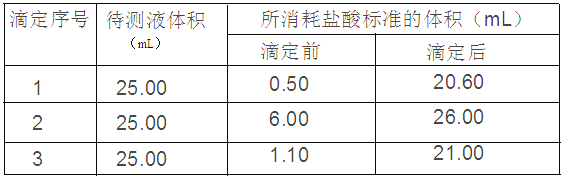
(1)用___________滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液。
(2)试样中NaOH的质量分数为______________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是________________。
Ⅲ.沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
A. H+、Ba2+、MnO4-、Cl- B. Cl-、CO32-、Cu2+、Mg2+
C. NO3-、SO42-、K+、H+ D. NO3-、OH-、Ba2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E、F的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E、F均能形成共价化合物。A和B形成的化合物在水中呈碱性。回答下列问题:
(1)五种元素中,原子半径最大的元素在周期表中的位置:__________________,非金属性最强的元素其原子结构示意图为:__________________________;
(2)能说明E、F非金属性强弱的事实是___________________(用一个化学方程式举例);
(3)用电子式表示C、E元素组成的化合物的形成过程:____________________________;
(4)由A和B、D、E、F所形成的共价化合物中,热稳定性最差的是_______(用化学式表示);
(5)D在不充足的F中燃烧,生成的主要产物的结构式为_________________________;
(6)A和F形成的化合物与A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为___________________________;
(7)写出F的同主族短周期元素的单质与水反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
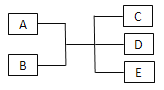
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从对化合物分类方法出发,指出下列各组物质中与其他物质类型不同的一种物质。 a.Na2O、CaO、SO2、CuO。
b.NaCl、KCl、NaClO3、CaCl2。
c.HClO3、KClO3、HCl、NaClO3。
d.NaHCO3、Ca(HCO3)2、NH4HCO3、K2CO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
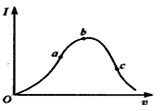
(1)“O”点导电能力为O的理由是 ;
(2)a、b、c三点溶液中c(H+)由小到大的顺序为 ;
(3)a、b、c三点中醋酸电离度最大的是 ;水电离程度最大的是 ;
(4)若使c点溶液的c(CH3COO-)提高,在如下措施中可采取 (填标号)。
A.加热
B.加盐酸
C.加冰醋酸
D.加入固体KOH
E.加水
F.加固体CH3COONa
G.加Zn粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com