
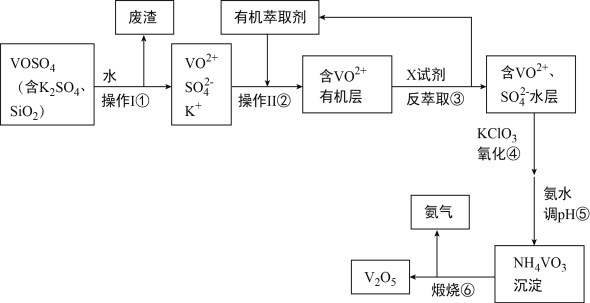
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如图所示:
回答下列问题:
(1)步骤①所得废渣与强碱反应得离子方程式_______________________________,操作Ⅱ的名称是_______________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
(3)按要求完成下列方程式。④的离子方程式为__________________,其中氧化剂与氧化产物的物质的量之比为_____________,若有245gKClO3参与反应时,转移的电子数目为__________。加氨水调节pH过程中涉及的离子方程式为:__________________________________。
(4)该工艺流程中可以循环利用的物质有_________________和_________________。
【答案】SiO2+2OH-=SiO32-+H2O萃取、分液H2SO46VO2++ClO3-+9H2O=6VO3-+Cl-+18H+1:612NANH3·H2O+H+=NH4++H2O NH4++VO3-=NH4VO3↓(填1个即算正确)氨气(或氨水或NH3或NH3·H2O)有机萃取剂(HA或有机溶剂或萃取后的有机层也给分)
【解析】
(1)VOSO4、K2SO4、SiO2中的VOSO4、K2SO4可溶于水,SiO2难溶于水;根据流程图可知操作Ⅱ是加入有机萃取剂后分液;(2)步骤③得到VOSO4,即R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高是还原剂,VO3-是氧化产物;
2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高是还原剂,VO3-是氧化产物;![]() ;加氨水调节pH过程中生成NH4VO3沉淀;(4)根据工艺流程图分析可以循环利用的物质。
;加氨水调节pH过程中生成NH4VO3沉淀;(4)根据工艺流程图分析可以循环利用的物质。
(1)VOSO4、K2SO4、SiO2中的VOSO4、K2SO4可溶于水,SiO2难溶于水,所以步骤①所得废渣是SiO2,SiO2与强碱反应生成硅酸盐和水,反应离子方程式是SiO2+2OH-=SiO32-+H2O;根据流程图可知操作Ⅱ是加入有机萃取剂后分液,所以操作Ⅱ是萃取、分液;(2)步骤③得到VOSO4,即R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动,所试剂X是H2SO4;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-,反应的离子方程式为6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高,VO2+是还原剂,VO3-是氧化产物,氧化剂与氧化产物的物质的量之比为1:6;
2RAn(有机层)+nH2SO4逆向移动,加入硫酸可使平衡逆向移动,所试剂X是H2SO4;(3)根据流程图,过程④是用KClO3把VO2+氧化为VO3-,反应的离子方程式为6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;KClO3中氯元素化合价降低是氧化剂、VO2+中V元素化合价升高,VO2+是还原剂,VO3-是氧化产物,氧化剂与氧化产物的物质的量之比为1:6;![]() ,245gKClO3参与反应时,转移的电子数目为
,245gKClO3参与反应时,转移的电子数目为![]() ;加氨水调节pH过程中生成NH4VO3沉淀,反应离子方程式是 NH4++VO3-=NH4VO3↓;(4)根据工艺流程图,该工艺流程中可以循环利用的物质有氨气和有机萃取剂。
;加氨水调节pH过程中生成NH4VO3沉淀,反应离子方程式是 NH4++VO3-=NH4VO3↓;(4)根据工艺流程图,该工艺流程中可以循环利用的物质有氨气和有机萃取剂。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】对下列两种有机物的描述正确的是
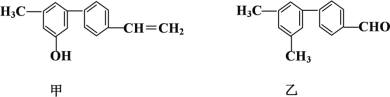
A. 苯环上的一氯代物种数相同
B. 分子中共面的碳原子数一定相同
C. 1 mol甲与浓溴水反应最多能消耗4 mol Br2
D. 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100 kJ·mol-1B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能大于100 kJ·mol-1D.正反应活化能比逆反应活化能小100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是
A.利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B.医院里的血液透析利用了胶体的性质
C.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料
D.二氧化硫是一种有毒物质,不能添加到任何食品中
查看答案和解析>>
科目:高中化学 来源: 题型:
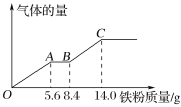
【题目】现有某稀硫酸和稀硝酸的混合溶液200 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。
下列分析或结果正确的是( )
A. 原混合溶液中NO3 -的物质的量为0.3 mol
B. OA段产生的是NO
C. BC段产生NO
D. 原混合溶液中H2SO4的浓度为1.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。X、Y、Z、W均为短周期元素,它们的质 子数之和为46。下列说法正确的是
![]()
A. 原子半径:W <X B. 气态氢化物的稳定性:Y <Z
C. 最髙化合价:X < Y D. 最髙价氧化物对应的水化物的酸性:Z < W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为

下列说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是

A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com