
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
【答案】B
【解析】
标准状况下,5.6LO2的物质的量是0.25mol;N2、CO和C2H4的摩尔质量都是28g/mol;盐酸是液体,不能利用![]() 计算物质的量;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1;
计算物质的量;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1;
标准状况下,5.6LO2的物质的量是0.25mol,含有电子数是![]() ,常温常压下,5.6LO2的物质的量不是0.25mol,故A错误;N2、CO和C2H4的摩尔质量都是28g/mol,根据极值法,28gN2、CO和C2H4的混合气体的物质的量是1mol,分子总数为NA,故B正确;盐酸是液体,不能利用
,常温常压下,5.6LO2的物质的量不是0.25mol,故A错误;N2、CO和C2H4的摩尔质量都是28g/mol,根据极值法,28gN2、CO和C2H4的混合气体的物质的量是1mol,分子总数为NA,故B正确;盐酸是液体,不能利用![]() 计算物质的量,故C错误;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1,1molNa被完全氧化生成Na2O2,失去NA个电子,故D错误。
计算物质的量,故C错误;Na被完全氧化生成Na2O2,钠元素化合价由0升高为+1,1molNa被完全氧化生成Na2O2,失去NA个电子,故D错误。


科目:高中化学 来源: 题型:
【题目】下列实验装置中,设计合理的是
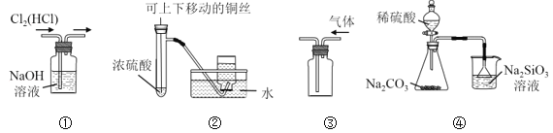
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B. 油脂是高级脂肪酸的甘油酯,在常温下均呈固态
C. CH3CH(NH2)COOH既能与盐酸反应、又能与氢氧化钠溶液反应
D. 合成橡胶![]() 的单体之一是CH3-C≡C-CH3
的单体之一是CH3-C≡C-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
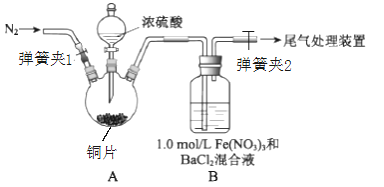
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92gNO2和N2O4混合气体中含有的原子数为3NA
B. 71g氯气与足量铁粉充分反应,转移的电子数为3 NA
C. 0.5mol·L-1的Ba(OH)2溶液中OH-的数目为NA
D. 1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如图所示:
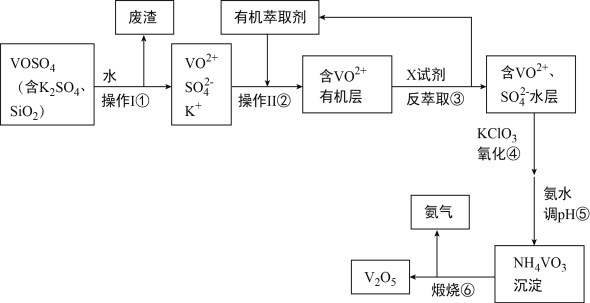
回答下列问题:
(1)步骤①所得废渣与强碱反应得离子方程式_______________________________,操作Ⅱ的名称是_______________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
(3)按要求完成下列方程式。④的离子方程式为__________________,其中氧化剂与氧化产物的物质的量之比为_____________,若有245gKClO3参与反应时,转移的电子数目为__________。加氨水调节pH过程中涉及的离子方程式为:__________________________________。
(4)该工艺流程中可以循环利用的物质有_________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 新制饱和氯水中:A13+、Cu2+、SO42-、Br-
B. 甲基橙变红的溶液:Mg2+、Fe2+、NO3-、SCN-
C.  的溶液中:Na+、K+、Cl-、AlO2-
的溶液中:Na+、K+、Cl-、AlO2-
D. 水电离的c(H+)=1×10-13mol/L的溶液中:Ca2+、Ba2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溴单质的沸点为 59 ℃,微溶于水,有毒性和强腐蚀性。某学习小组在探究从工业溴中提溴单质的实验中使用如下装置:

(1)①实验室保存液溴的方法是:_____,图中仪器 B 的名称是:_____。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_____。
④C 中液体产物的颜色为_______,为除去该产物中仍残留的少量 Cl2,可向其中加入 NaBr 溶液,充 分反应后,再进行的分离操作是_______(填操作名称)。
⑤工业上常用 SO2 水溶液吸收 Br2,有关反应的离子方程式为__________。
(2)Br2 和 FeCl3 的稀溶液均呈黄色。将少量稀溴水滴入稀 FeCl2 溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,他认为二者未发生化学反应,该实验设计不正确,错误在于____________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com