
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
【答案】B
【解析】A、由于反应在体积可变的恒压密闭容器中进行,当550℃时,若充入惰性气体,容器的容积扩大,使反应混合物的浓度减小,因此正,逆 均减小,由于该反应是气体体积增大的反应,减小压强,化学平衡向气体体积最大的正反应方向移动,A错误;B.根据图像可知在650℃时,反应达平衡后CO的体积分数是40%,则CO2的体积分数是60%,假设平衡时总物质的量是1 mol,则反应产生CO 0.4 mol,其中含有CO2 0.6 mol,反应产生0.4 molCO消耗CO2的物质的量是0.2 mol,因此CO2转化率为0.2 mol÷(0.6 mol+0.2 mol)×100%=25.0%,B正确;C.T℃时,平衡时CO2和CO的体积分数都是50%,若充入等体积的CO2和CO,化学平衡不移动,C错误;D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=![]() ,D错误。答案选B。
,D错误。答案选B。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:

(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中评价正确的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 向NaAlO2溶液中通入过量的CO2:AlO2-+2CO2+H2OAl3++3HCO3- | 正确 |
B | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-Cu(OH)2↓+SO42- | 错误,CuSO4应拆分成离子形式 |
C | 向盐酸中滴入氨水:H++OH-H2O | 正确 |
D | 硫化钠的第一步水解:S2-+H2O | 错误,应该为S2-+2H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是_______,所用玻璃仪器有____________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为_____________溶液(写化学式);在III步中,判断试剂乙已加入过量的方法是:_______________。
(3)固体H所含物质的化学式为_________________________________________。
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,此过程中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图九种物质均是由短周期元素组成的常见物质,X、Y、Z为单质,A、E、F、G为二元化合物,A的焰色反应为黄色,B常温常压下为无色易挥发的液体。E为合成食品保鲜膜的单体,回答下列问题:

(1)A是________(填化学式),为_______化合物(填“离子”或“共价”)。
(2)E的电子式为_______,G的水溶液为________(填“强酸”或“弱酸”)。
(3)写出B与浓D反应的化学方程式________,该反应类型为________。
(4)F的核磁共振氢谱有______个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是( )
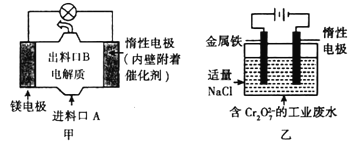
A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com