
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是 ( )。
3C+5D反应中,表示该反应速率最快的是 ( )。
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 0.3 mol/(L·s)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/(L·s)
科目:高中化学 来源: 题型:
【题目】碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O![]() KIO3+3H2↑,有关说法不正确的是( )
KIO3+3H2↑,有关说法不正确的是( )
A.石墨作阳极,不锈钢作阴极
B.I-在阳极放电,H+在阴极放电
C.电解过程中电解质溶液的pH变小
D.电解转移3 mol e-时,理论上可制得KIO3107 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A. ①②③④ B. ②③⑤⑦⑧ C. ⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示金属X、Y及它们的合金Z分别与足量盐酸反应放出H2量的情况,横坐标表示消耗金属的物质的量,纵坐标表示在标准状况下产生H2的体积.下列有关合金组成的判断正确的是

A. n(Na)∶n(Fe)=2∶1 B. n(Mg)∶n(K)=1∶2
C. n(Na)∶n(Al)=1∶3 D. n(K)∶n(Al)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。

(1) C中导管末端连接一个多孔球泡D,其作用是 ,可以提高实验的准确度。
(2) C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是 (氧化剂、还原剂)。
(3) 某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还 原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 , (试剂任选,请完善步骤、现象和结论)。
(4) ① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为 g/L。 (相对原子质量: Ba-137 S-32 O-16)
② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3, 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。


(1)图2中仪器a的名称是_________________。
(2)根据题目要求,在图2中最好选择_____________(填序号)作为A装置。
(3)对图2中装置②进行气密性检查的方法是__________________________。
(4)在B装置中发生的主要反应的化学方程式是_________________________。
(5)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有__________(填名称)。
(6)写出Fe3O4溶于足量稀硫酸的离子方程式 ,要检验所得溶液中的Fe3+,常用试剂是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大。请完成下面问题:
(1)冶炼后的铝渣中含有大量的硅酸铝钙(Al2Ca2Si5O15),可作耐火纤维的原料。硅酸铝钙用氧化物形式表示为__________________。
(2) 由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(3)高铁电池具有容量高、安全性能好和价格低廉等特点,如图是高铁电池的实验装置。

已知:放电后两极得到相同价态铁的化合物。
①电池放电时正极发生的电极反应式是______________。
②若该电池属于二次电池,则充电时阴极的电极反应式为_______________________。
③已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
Ⅰ.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
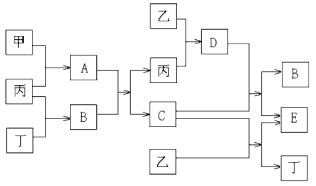
(1)A和E的化学式分别为____________、_____________;
(2)A+B → C+丙的化学方程式:____________________________;
(3)D+C → B+E的离子方程式:________________________________;
(4)1 mol甲和1 mol乙混合投入到足量的B中,在标准状况下,最多能产生________L丁气体。
Ⅱ.在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸,然后分别慢慢加入组成相同的铝镁混合物,得下表中有关数据(反应前后溶液体积不发生变化)。
实验序号 | 甲 | 乙 | 丙 |
混合物质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸__________(填“过量”、“适量”或“不足”);
乙组实验中,盐酸__________(填“过量”、“适量”或“不足”)。
(2)盐酸的物质的量的浓度为_____________mol/L。
(3)混合物中Mg和Al的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com