
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1) 以CO2与NH3为原料合成化肥尿素的主要反应如下:
① 2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol1
② NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol1
③ 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol1
则a为____。
(2) 尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
① 当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=____(空气中氧气的体积含量大约为20%)。
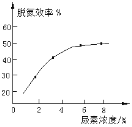
② 如图表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为____%。
(3)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图所示。
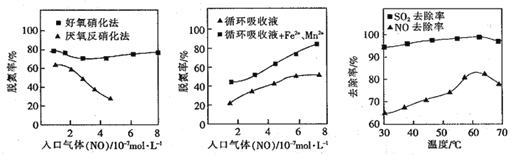
① 由图知,当废气中的NO含量增加时,宜选用____法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为____。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为____。
【答案】+72.49 1:1 5(±0.2) HNO22e+H2O=3H++NO3 好氧硝化 Fe2+、Mn2+对该反应有催化作用 温度升高H2O2分解速率加快
【解析】
(1)根据所给反应,依据盖斯定律可求a;
(2)根据方程式,可以看出,当烟气中NO、NO2按1:1是效率最佳,分析计算当V(NO):V(NO2)=5:1时,通入的空气将NO和NO2的体积比变为1:1,从而确定空气和NO的体积比;由图中的曲线变化分析,随尿素浓度变化,脱氮效率的变化,可得结论;
(3)依据电解原理,阳极发生失去电子的氧化反应,在阳极亚硝酸失电子生成硝酸;
(4)观察图中曲线的变化情况,即可得出结论;
(5)NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,但其中的H2O2,温度升高分解速率加快,NO去除率下降;
(1)①![]() ,
,
②![]() ,
,
③![]()
由盖斯定律可得②=③-①得:a=-86.98kJ/mol-(-159.47kJ/mol)=+72.49kJ/mol;
本题答案为:+72.49;
(2)①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳,即1:1,若烟气中V(NO):V(NO2)=5:1时,设通入空气中氧气体积为x;2NO![]() O2=2NO2
O2=2NO2
2x x 2x 有![]() =1:1
=1:1
计算得到x=1,空气体积为5,所以同温同压下,V(空气)∶V(NO)=1:1;
②由图中的曲线可以看出,尿素浓度达到![]() 之前,脱氮效率随着尿素浓度的增加而增加;尿素浓度达到
之前,脱氮效率随着尿素浓度的增加而增加;尿素浓度达到![]() 后,脱氮效率随着尿素浓度的增加变化很小;因此从经济因素上考虑,尿素浓度一般约为
后,脱氮效率随着尿素浓度的增加变化很小;因此从经济因素上考虑,尿素浓度一般约为![]() ;
;
本题答案为:1:1 ,![]() ;
;
(3)依据电解原理,阳极发生失去电子的氧化反应,在阳极亚硝酸失电子生成硝酸,电极反应式为:HNO22e+H2O=3H++NO3;
本题答案为:HNO22e+H2O=3H++NO3;
(4)①图I可以看出,当废气中的NO含量增加时,好氧硝化法,脱氮率高,故应选好氧硝化法;
②从图Ⅱ不难看出,在同等条件下,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,所以Fe2+、Mn2+对该反应有催化作用;
本题答案为:好氧硝化,Fe2+、Mn2+对该反应有催化作用;
(5)NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,但其中的H2O2,温度升高分解速率增大,从图III可以看出,使NO去除率下降;
本题答案为:温度升高H2O2分解速率加快。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.活化分子的平均能量称为活化能
B.活化分子互相碰撞即可发生化学反应
C.催化剂是通过增大反应所需的活化能来增大反应速率的
D.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在容积不变的密闭容器中发生如下可逆反应:2M(g)+N(g) ![]() 2E(g),若开始只充入2 mol E(g),达到平衡时,E的转化率为40%;若开始时充入2mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始只充入2 mol E(g),达到平衡时,E的转化率为40%;若开始时充入2mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A. 20% B. 40% C. 60% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A. 以X浓度变化表示的反应速率为0.01mol/(L·s)
B. 将容器体积变为20L,Z的平衡浓度为原来的1/2
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)![]() 4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
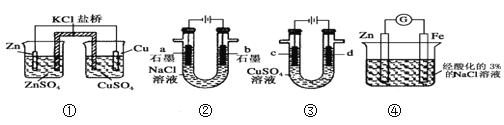
A. 装置②中滴入酚酞,a极附近变红B. 装置①中,一段时间后SO42﹣浓度增大
C. 用装置③精炼铜时,c极为粗铜D. 装置④中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的叙述正确的是
A.铁粉在Cl2中燃烧生成FeCl2B.铁单质只有还原性,其阳离子只有氧化性
C.Fe(OH)3可经化合反应一步得到D.因为Fe的活泼性大于Cu,故Cu与FeCl3不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关蛋白质的叙述中不正确的是( )
A.向蛋白质溶液滴加硫酸铜溶液发生盐析
B.蛋白质遇浓硝酸显黄色
C.蛋白质溶液具有丁达尔效应
D.蛋白质的基本结构单元是氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com